 化合物是一种香料,存在于金橘中,可用如下路线合成:
化合物是一种香料,存在于金橘中,可用如下路线合成:



已知:
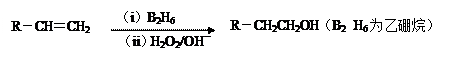

 回答下列问题:
回答下列问题:
 (1)11.2(标准状况)的烃在氧气中充分燃烧可以产生88 和45 。
(1)11.2(标准状况)的烃在氧气中充分燃烧可以产生88 和45 。
 的分子式是
的分子式是
 (2)和均为一氯代烃,它们的名称(系统命名)分别为;
(2)和均为一氯代烃,它们的名称(系统命名)分别为;
 (3)在催化剂存在下1 与2 反应,生成3-苯基-1-丙醇。F的结构简式是
(3)在催化剂存在下1 与2 反应,生成3-苯基-1-丙醇。F的结构简式是
 (4)反应①的反应类型是;
(4)反应①的反应类型是;
 (5)反应②的化学方程式为
(5)反应②的化学方程式为
 (6)写出所有与具有相同官能团的的芳香类同分异构体的结构简式:
(6)写出所有与具有相同官能团的的芳香类同分异构体的结构简式:

苯佐卡因可用于粘膜溃疡、创面等的镇痛,是一种常用的局部麻醉剂,其合成路线如下图所示:
已知:① 当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
请回答下列问题:
(1)上述合成路线中属于取代反应的是 。(填代号)。
化合物C中含有的含氧官能团的名称为 。
(2)合成路线中反应①的化学方程式为 。
(3)下列关于上述合成路线的说法中正确的是 。(填字母)
a.反应①除主要生成物质A外,还可能生成 、
、 等
等
b.步骤①和②可以互换
c.反应③是还原反应
(4)苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: 。
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。
(5)化合物 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。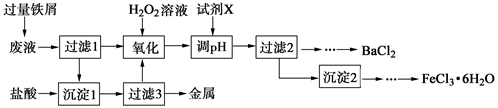
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
| A.BaCl2 | B.BaCO3 | C.NaOH | D.Ba(OH)2 |
(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。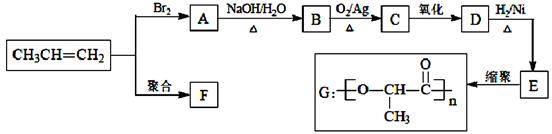
(1)聚合物F的结构简式是_____________________________________。
(2)D的结构简式是 。
(3)B转化为C的化学方程式是 。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是 _________________________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为__________________________________。
已知A、B、C、D、E都是周期表中的前四周期的元素, 它们的核电荷数A<B<C<D<E。其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示。原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
试回答下列问题: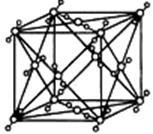
(1)基态Ga原子的核外电子排布式为: 。
(2)A、B、C的第一电离能由大到小的顺序: (用元素符号表示)。
(3)B元素的单质分子中有 个π键,与其互为等电子体的物质的化学式可能为 (任写一种)。
(4)上述A的氧化物分子中心原子采取 杂化,其晶胞中微粒间的作用力为 。
(5) EH3分子的空间构型为 ,其沸点与BH3相比 (填“高”或“低”),原因是
(6)向CuSO4溶液中逐滴加入BH3的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式 .
“低碳循环”引起各国的高度重视,而如何降低大气中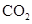 的含量及有效地开发利用
的含量及有效地开发利用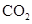 ,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: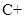
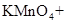
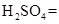
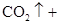
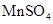 +
+ 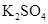 +
+ 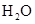
(2)将不同量的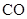 (g)和
(g)和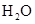 (g)分别通入到体积为 2L的恒容密闭容器中,进行反应
(g)分别通入到体积为 2L的恒容密闭容器中,进行反应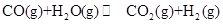 ,得到如下二组数据:
,得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
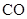 |
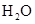 |
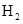 |
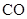 |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以 表示的反应速率为 (保留二位小数,下同)。
表示的反应速率为 (保留二位小数,下同)。
②实验2条件下平衡常数K=___ ___,该反应为 (填“吸”或“放”)热反应。
(3)已知在常温常压下:
①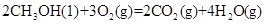
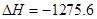 kJ/mol
kJ/mol
②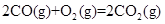
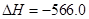 kJ/mol
kJ/mol
③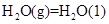
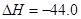 kJ/mol
kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。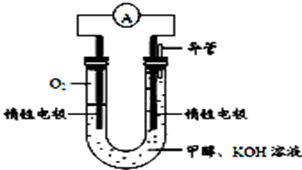
①该电池正极的电极反应为 。
②该电池工作时,溶液中的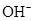 向____________极移动。
向____________极移动。