已知热化学方程式H2 (g) + F2 (g) ="==" 2 HF (g) △H = -270 kJ· mol-1,下列说法中错误的是
| A.在上述条件下,44.8 L氟化氢气体分解成22.4 L氢气与22.4 L氟气吸收270 kJ热量 |
| B.在上述条件下,1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出热量大于270 kJ |
| C.在上述条件下,1 mol氢气与 1 mol氟气的能量总和大于 2 mol氟化氢气体的能量 |
| D.上述热化学方程式还可表示为:1/2 H2 (g) +1/2 F2 (g)="==" HF (g) △H = -135 kJ· mol-1 |
对三联苯是一种有机合成的中间体。工业上合成对三联苯的化学方程式为( )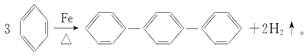
下列说法中正确的是( )
| A.上述反应属于取代反应 |
| B.对三联苯分子中至少有18个原子共平面 |
| C.对三联苯的一氯取代物有4种 |
| D.0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2 |
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍为10L,下列各组混合烃一定不符合此条件的是()
| A.CH4、C2H4 | B.C2H2、C3H6 | C.C2H4、C3H4 | D.CH4、C 3H6 |
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与足量氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是()
| A.3mol | B.4mol | C.5mol | D.6mol |
下列有机反应的产物中不可能存在同分异构体的是( )
| A.CH3CH===CH2与HCl加成 |
| B.CH3CH2CH2Cl在碱性溶液中水解 |
| C.CH2===CH—CH===CH2与H2按物质的量之比为1﹕1进行反应 |
D. 与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
下列说法错误的是( )
| A.蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 |
| B.提纯液体混合物常用重结晶法 |
| C.萃取是利用溶质 在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 。 |
| D.常用质谱法进行有机物相对分子质量的测定 |