(1)家用液化气的主要成分之一是丁烷(C4H10),当2 mol丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5800kJ,试写出表示丁烷燃烧热的热化学方程式: ;
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) ΔH =" -24.8" kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ΔH =" -47.4" kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H =" +640.5" kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)和CO2(g)的热化学反应方程式 。
Suzuki偶联反应在有机合成上有广泛应用,该方法可以应用于合成昆虫信息素。其反应①如下(Ph-代表苯基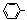 ):
):
反应①: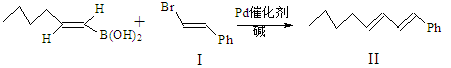
化合物I可以由以下途径合成: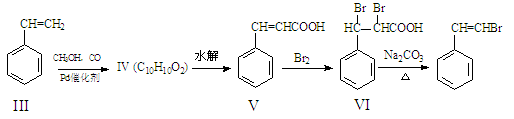
(1)化合物I的分子式为 ,1mol化合物III完全燃烧消耗氧气 mol。
(2)化合物IV的结构简式为 ,化合物V转化为化合物VI的反应类型为 。
(3)写出化合物VI在足量的NaOH溶液中共热反应的方程式 。
(4)已知化合物Ⅶ是化合物V的同分异构体,化合物Ⅶ的核磁共振氢谱中有 4种峰,峰面积之比为3:2:2:1,且1mol Ⅶ与足量银氨溶液反应生成4mol Ag单质,写出化合物Ⅶ的结构简式 。
(5)化合物(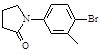 )与化合物(
)与化合物( )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式 。
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式 。
有机物A(肉桂酸甲酯)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。它的核磁共振氢谱图上有6个峰,峰面积之比为1:2:2:1:1:3。它的红外光谱如下图: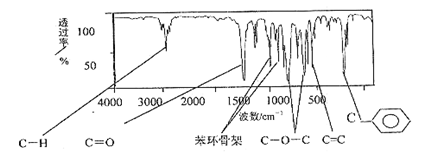
用A为原料合成高分子化合物H的路线如下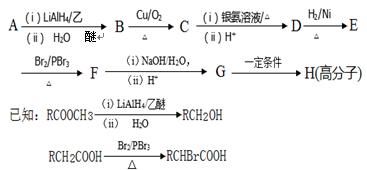
回答下列问题:
(1)A的结构简式是 。
(2)B与Br2的CCl4溶液反应后的生成物中手性碳原子的数目为 。
(3)请写出B生成C的化学方程式 。
(4)请写出同时满足下列条件下C的所有同分异构体的结构简式: 。
①分子中不含羰基和羟基;②是苯的对位二元取代物;③除苯环外,不含其他环状结构。
(5)请写出G生成H的化学方程式 。
(6)溴苯与丙烯酸甲酯在氯化钯催化下可直接合成A,为了促进反应的进行,通常可加入一种显 (填字母)的物质。
| A.弱酸性 | B.弱碱性 | C.强酸性 | D.强碱性 |
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。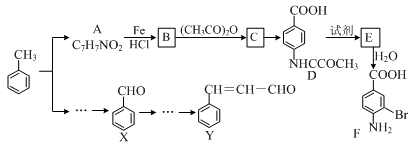
已知:①
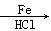
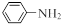
②2CH3CHO 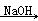 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO 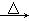 CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
(2)C→ D的反应类型是 。
(3)B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子
②分子中含有 -CHO
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO  CH3COOH
CH3COOH 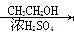 CH3COOCH2CH3
CH3COOCH2CH3
有机物F的合成路线如图所示: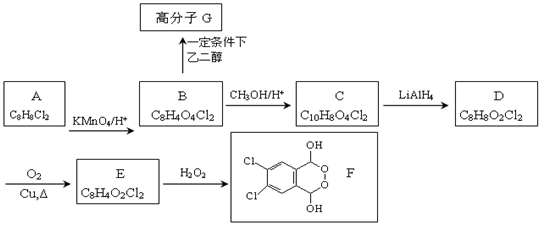
已知以下信息:
(1)RCOOR’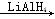 RCH2OH
RCH2OH
(2)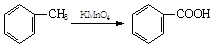
回答以下问题:
(1)A的结构简式为 ,G的结构简式为 。
(2)B生成C的化学方程式为 。
(3)检验E中含氧官能团的试剂是 ,现象是 。
(4)E→F的反应类型是 。
(5)A的同分异构体中,符合下列条件的同分异构体有 种(不包含A),写出其中一种的结构简式 。
①属于芳香族化合物
②苯环上有四个取代基
③苯环上的一溴取代物只有一种
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l :1。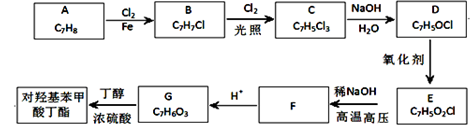
回答下列问题:
(1)A的化学名称为 ;
(2)由B生成C的化学反应方程式为 ;
该反应的类型为 ;
(3)D的结构简式为 ;
(4)F的分子式为 ;
(5)G的结构简式为 ;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有 种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1,的是 (写结构简式)。