用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):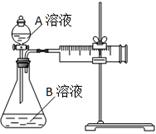
| 实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL)
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
(4)小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、② 。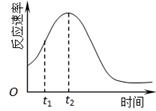
(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
| 实验 编号 |
KClO3 (g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
| 化学式 |
质量(g) |
回收 |
||||
| 1 |
0.6 |
— |
— |
— |
10 |
480 |
| 2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
| 3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
| 4 |
0.6 |
Fe2 O3 O3 |
0.20 |
90% |
67.2 |
34.7 |
| 5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
(9分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)X的电极名称是(填写“阳极”或“阴极”)。
(2)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是,Y电极的材料是。
(3)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是,Y极上的电极反应式为。
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾 气进行吸收处理。
气进行吸收处理。
(1)请写出MnO2和浓盐酸制备Cl2的离子方程式________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO 4+H2O中的还原剂为_______________
4+H2O中的还原剂为_______________ _.
_.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;假设2:既不存在SO3 2-也不存在ClO
2-也不存在ClO ;
;
假设3:_____________.假设4:
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
|
| 步骤2: |
|
| 步骤3: |
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
试回答下列问题
(1)操作①搅拌的目的是:。
(2)操作 ②与操作③相同,该操作名称是:___________________。
②与操作③相同,该操作名称是:___________________。
(3)反应器中, NaOH、NaClO及Fe(NO3)3反应的离子方程式为:_______________________。
NaOH、NaClO及Fe(NO3)3反应的离子方程式为:_______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)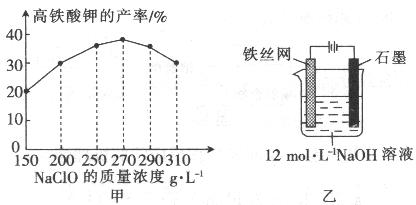
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为。
(10分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现 象是,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)
象是,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)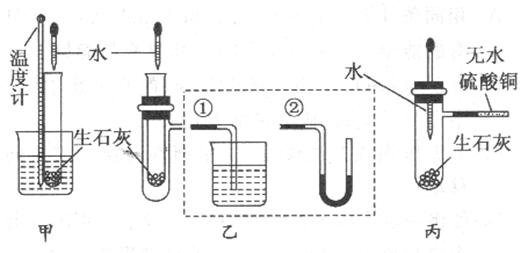
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①),(接②),说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是,说明反应放热,其原因是 。
。