⑴材料是人类赖以生存和发展的重要物质基础。
①住宅建设需大量的建筑材料,下列物质属于复合材料的是 (填字母)。
a.水泥 b.PVC下水管道 c.玻璃 d.钢筋混凝土
②现代生活离不开金属材料,下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是 (填字母)。
a.涂油漆 b.包塑料层(镀塑) c.制成不锈钢
③废品收购人员发现金属铝做的易拉罐“不生锈”,而铁生锈最厉害,便认为金属铁比铝性质活泼.你认为易拉罐“不生锈”原因是 ;用盐酸可除去铁尺上的铁锈(主要成分为Fe2O3),请您写出除去铁锈的化学方程式 ;
④废旧电池中含有汞,如果随意丢弃,会造成污染,威胁人类健康.汞的元素符号是 ,金属汞在常温下的状态是 。常用的干电池内部填有氯化铵和等物质,在实验室分离氯化铵和二氧化锰混合物,可进行的操作是:溶解、过滤和 ;得到的氯化铵在农业上又可用作 。
⑵2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
①汽车上加装尾气催化净化装置可以使NO、CO相互反应转化为空气中含有的两种气体。名称分别为 和 。
②煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是 (填化学式)。在煤中加入适量石灰石,在氧气的共同作用下,可以与煤燃烧产生的SO2反应生成硫酸钙和二氧化碳气体,发生反应的化学方程式为 。
⑶某种食品的配料标签如图所示。
①该配料中,富含蛋白质的物质是 ,富含油脂的物质是 。
②该配料中的 具有防腐作用。
③请写出检验淀粉的实验方法和现象: 。
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为0.56mol(填“大于”、“等于”或“小于”),原因是。
(2)870g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?
在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中:
(1) 元素得电子, 元素被氧化(填元素名称)。
(2)氧化产物与还原产物的粒子数目之比为_________,氧化剂与还原剂的粒子数目之比是 。
(3)若有7.3gHCl被氧化,则产生Cl2的质量为_______g。
(4)该反应的离子方程式为。
同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的组合是。反应条件:①锌粒;②锌片;③锌粉;④5%盐酸;⑤10%盐酸;⑥15%盐酸;⑦加热;⑧用冷水冷却;⑨不断震荡;⑩迅速混合后静置。欲使反应速率进一步增大,可采取的措施是(列举一条)。
反应A+3B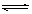 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①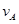 =0.15mol/(L·min)②
=0.15mol/(L·min)②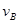 =0.01mol/(L·s)
=0.01mol/(L·s)
③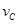 =0.40mol/(L·min) ④
=0.40mol/(L·min) ④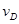 =0.45mol/(L·min),
=0.45mol/(L·min),
该反应进行的快慢顺序为(填序号)。
已知反应4NH3(g)+5O2(g)==4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了4.5mol,试计算分别用NH3、O2、NO、H2O四种不同物质表示的该反应的反应速率。