下列说法中,正确的是
| A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4.5 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
主族元素M、R形成的简单离子M2-离子与R+离子的核外电子数之和为20,下列说法正确的是
| A.M原子的质子数一定大于R原子的质子数 |
| B.M可能存在16M、18M两种核素 |
| C.M2-的离子与R+的电子层结构不可能相同 |
| D.两种离子结合形成的化合物中可能含有共价键 |
某有机物的结构简式如图所示,下列说法正确的是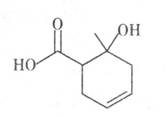
| A.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 |
| B.含有两种官能团 |
| C.与乙酸互为同系物 |
| D.可以发生取代反应和加成反应,但不能发生聚合反应 |
下列说法中,正确的是
| A.利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe2+的还原性 |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜 |
下列有关叙述不正确的是
| A.MgO、Al2O3熔点高,可用于制作耐火材料 |
| B.用浓氢氧化钠溶液可除去乙酸乙酯中混有的乙酸、乙醇杂质 |
| C.除去NaCl溶液中的Na2CO3,应选择试剂为盐酸,而不是硝酸 |
| D.油脂在碱性条件下易发生水解,可用于制作肥皂 |