2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 Pt的说法正确的是
Pt的说法正确的是
A. Pt和 Pt和 Pt的质子数相同,互称为同位素 Pt的质子数相同,互称为同位素 |
B. Pt和 Pt和 Pt的中子数相同,互称为同位素 Pt的中子数相同,互称为同位素 |
C. Pt和 Pt和 Pt的核外电子数相同,是同一种核素 Pt的核外电子数相同,是同一种核素 |
D. Pt和 Pt和 Pt的质量数不同,不能互称为同位素 Pt的质量数不同,不能互称为同位素 |
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物 ,下列说法正确的是
,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
C. 可能是离子化合物,也可能是共价化合物 可能是离子化合物,也可能是共价化合物 |
| D.两元素形成的化合物中,原子个数比不可能为1:1 |
如图中M、N为含X元素的常见化合物,则 X元素为羧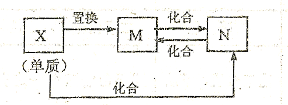
| A.C或Al | B.Cu或Fe | C.N或S | D.Fe或C |
下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水 |
B.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合 |
C.在稀氨水中通入过量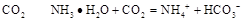 |
D.铁片放入过量的稀硝酸中: |
下图是电解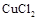 溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是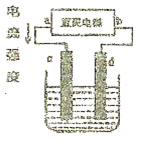
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
下列说法正确的是
A.对于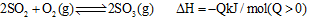 ,若向一密闭容器中加入1mol ,若向一密闭容器中加入1mol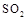 和0.5mol 和0.5mol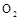 充分反应后,放出的热量为0.5 充分反应后,放出的热量为0.5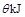 |
| B.热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 |
| C.需要加热才能发生的反应不一定是吸热反应 |
D.小苏打在水中的电离方程式: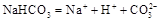 |