已知X、Y、Z、W、M五种元素,X、Z、W在元素周期表位置如下周期表,
① ZX4+ + WX- ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
分子中质子数相等。回答下列问题: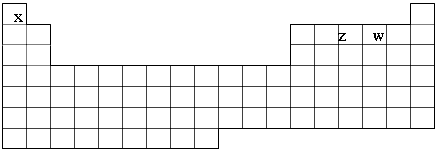
(1).在周期表中写出M,Y的元素符号;
(2).写出ZX3的化学键类型: ;
(3).写出M单质与NaOH溶液反应的离子方程式 ;
(4).M的最高价氧化物对应水化物与Z的最高价氧化物对应的水化物反应的化学方程式为: 。
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下表:请回答下列问题:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0 ( 填“>”.“<”或“=” );
(2)在体积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A减少Fe的量B增加Fe2O3的量 C移出部分CO2
D提高反应温度 E减小容器的容积 F加入合适的催化剂
常温下有下列四种溶液:
| ① |
② |
③ |
④ |
|
| 溶液 |
pH=4的NH4Cl |
pH=4的盐酸 |
0.1 mol·L-1的醋酸 |
0.1 mol·L-1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10-5。请回答下列问题:
(1)用④的标准液滴定③宜选用 (填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 。
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是 (用序号表示),用pH试纸测定溶液pH的操作方法是 。
(3)都是0.1mol/L的①NH4Cl.②NH4HCO3.③CH3COONH4.④NH4HSO4的溶液中NH4+离子浓度大小顺序为 。(用序号填写)
(4)取适量溶液③滴定20 mL溶液④,滴定曲线如右图所示,则a点时溶液中各离子浓度的大小关系为 。若b点时消耗③的体积为V mL,则V 20(填“>”.“<”或“=”)。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2 (填大或小);(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① |
HF |
Ka=6.8×10-4 mol•L-1 |
| ② |
CH3COOH |
Ka=1.7×10-5 mol•L-1 |
| ③ |
HCN |
Ka=6.2×10-10 mol•L-1 |
| ④ |
H2CO3 |
Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最弱的是_____________________。
(2)写出H2CO3电离方程式是 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合: ______,少量的CO2通入NaCN溶液中: _____。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O)D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。