A、B、C、D、E五种短周期主族元素,原子序数依次增大。A原子的核外电子数等于最外层电子数;B原子的最外层电子数是次外层电子数的2倍;C原子的M层电子数与L层电子数相差7;D原子的最外层电子数是A、B、C三原子的最外层电子数之和。回答下列问题。
(1)元素B在周期表中的位置为第 周期 族;元素D简单离子的结构示意图为 。
(2)元素C、D简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)元素B可形成离子BH3-,下列与其具有相同电子数和质子数的微粒是 。
A.NH4+ B.OH- C.F- D.HS-
(4)元素A、C组成化合物甲CA,甲能与水反应产生一种强碱和一种气体,该反应的化学方程式为 。
(5)A元素有aA、a+1A、a+2A三种同位素,E元素有eE、e+2E两种同位素,二者所形成分子的相对分子质量有 种。
(1)下列是钠、碘、金刚石、锌、氟化钙晶体的晶胞图(未按顺序排序)。与冰的晶体结构相符的是________(请用相应的编号填写)。
(2)写出丙醛与新制氢氧化铜悬浊液反应的化学方程式:
____________________________________________________________________________________
请回答下列问题:
(1)解释CO2为直线形分子的原因。
(2)甲醇的沸点比甲醛的高,其主要原因是。
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、 CrO3、CrO5等。其中CrO5的结构式如图所示,请写出该物质中铬元素的化合价为________,标有“*”的氧原子的化合价为___________。
(2)氧元素可以和氢元素形成原子个数比为1:1的分子,该物质在酸性条件下与Fe2+发生反应的离子方程式为________________________________________________________________________。
(3)氧元素还可以形成多种离子,在NO2+中氮原子轨道杂化类型是。
某学生用浓度为0.1 mol/L左右的KOH溶液滴定未知浓度的盐酸,有如下操作步骤:
(A)移取20.00 mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用KOH溶液润洗滴定管2—3次
(C)把盛有KOH溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取KOH溶液注入碱式滴定管至0刻度以上2—3 cm
(E)调节液面至O或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用KOH溶液滴定至终点,记下滴定管液面的刻度
回答下列问题:
(1)正确操作的顺序是(填编号)
(2)实验室可提供下列浓度的KOH浓液,应选用的是。(填编号)
A.0.1 mol/L B.O.10 m01/L C.O.1032 mol/L
(3)(A)操作中量取待测液的仪器是o
(4)(B)操作的目的是.
(5)(F)操作中判断到达终点的现象是。
(6)(B)如被省略所测结果(填“偏大”、“偏小”、“不变”).
(7)KOH溶液在空气中易变质生成,该物质水溶液PH7,其水溶液中离子浓度大小排序为
(8)(C)步如何使滴定管尖嘴充满溶液
物质A—E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000 mL,pH的变化如图l所示,其中A与D反应得到E。请回答: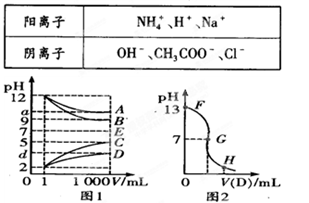
(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B.,D.。
(2)图l中a>9的理由是。
(3)另取浓度为C1的B溶液25 ml,向其中逐滴滴加0.2 mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为 。
②G点溶液呈中性,则加入D溶液的体积V(填“>”、“<’’或“=”)12.5 mL;
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=。