C3H7Cl的结构有两种,分别为CH3CH2CH2Cl和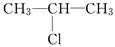
(1)CH3CH2CH2Cl在NaOH水溶液中受热反应的化学方程式是________________________________________________________________________,
反应类型为________.
(2) 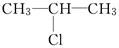 在NaOH乙醇溶液中受热反应的化学方程式是
在NaOH乙醇溶液中受热反应的化学方程式是
________________________________________________________________________,
反应类型为________.
A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、内为常见的化合物,甲物质具有磁性。它们之间有如图1的转化关系:
请回答下列问题:
(1)B与甲反应的化学方程式是。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和 现象是。
现象是。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,如图2是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。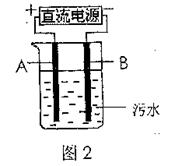
阳极的电极反应分别是,2H2O-4e-=4H++O2↑;
阳极区生成沉淀的离子方程式是。
X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数 是其电子层数的2倍,Z是人体中含量最高的金属元素。
是其电子层数的2倍,Z是人体中含量最高的金属元素。
(1)下列含氧酸根化学式书写不正确的是(填序号)。
a.XO3- b.XO32- c.YO32-d.Y2O32-
(2)X、Y的原子可构成只含极性键的非极性分子;它的电子式是,空间构型是。
(3)Y的最高价含氧酸是重要的化工产品。
①已知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量。该反应的热化学方程式是。
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如表。Y在纯氧中燃烧的产物中YO3含量比空气中少,试分析其原因。
| YO2 |
YO3 |
|
| 空气 |
94%—95% |
5%—6% |
| 氧气 |
97%—98% |
2%—3% |
2,3-二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成: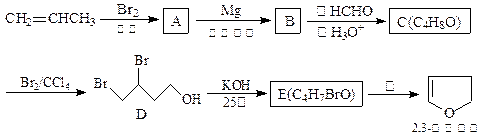
已知:
1、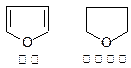
2、
回答下列问题:
(1)请用系统命名法命名化合物D。
(2)①反应③的条件是。
②写出C、E的结构简式:
C、E。
(3)工业上由化合物F(C4H10O2)在少量硫酸存在下可制得四氢呋喃,写出反应方程式: 。
。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式。
① 没有支链,且一取代产物只有两种;
② 与银氨溶液不发生银镜反应。
(5)2,3-二氢呋喃在一定条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化?
【物质结构与性质】
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)CH3+、·CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp3杂化,所有原子均共面 |
(2)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电 量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
①HCl、CS2、H2S、SO2四种分子中μ=0的是;
②实验测得:μPF3 =1.03、μBCl3=0。由此可知,PF3分子是构型,BCl3分子是构型。
=1.03、μBCl3=0。由此可知,PF3分子是构型,BCl3分子是构型。
(3) 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
(4)利用光电子能谱证实 :在洁净铁(可用于合成氨
:在洁净铁(可用于合成氨
反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原子数之比为________________。
(5)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积(填“A”或“B”)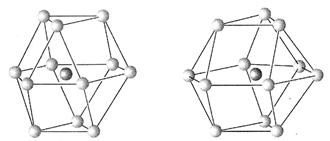
图A图B
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。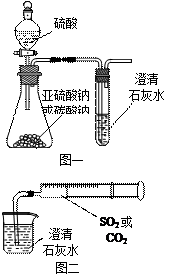
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
| 饱和石灰水与水的体积比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
| 能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073 |
0.055 |
0.037 |
0.028 |
① 上表中A=g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
| 热力学温度/K |
282 |
298 |
308 |
| CaCO3溶解度(g/100水) |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
| P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
| CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是: