下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
请按要求回答下列问题:
(1) 写出②的元素名称 ;
(2) 将④、⑤和⑥三种元素相比较,金属性最强的是 (填元素符号);
(3) 元素③的最高价氧化物对应的水化物的化学式为 ;
(4) 元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 。
物质A~E都是中学化学中常见的物质,它们可以发生如下图所示的反应:
(1)写出相应物质的名称和类别:
| A |
B |
C |
D |
E |
|
| 名称 |
|||||
| 类别 |
(2)在以上反应中(用序号填空):
属于氧化还原反应的是________,属于置换反应的是________,属于分解反应的是________,属于化合反应的是________,属于复分解反应的是________,属于离子反应的是________。
(3)写出反应③的离子方程式:___________________________。
写出下列反应的化学方程式。若是氧化还原反应,请用“双线桥”分析(指出氧化剂、还原剂)。
(1)电解食盐水制取氯气
(2)氯气通入溴化钾溶液中
(3)漂白粉中的次氯酸钙与水蒸气、二氧化碳作用
(18分)(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:。
(2)3d能级为半充满的正三价离子,该离子的电子排布式为。
(二)A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
| 甲 |
乙 |
丙 |
丁 |
|
| 化合物中各元素原子个数比 |
A和C 1∶1 |
B和A 1∶2 |
D和E 1∶3 |
B和E 1∶4 |
(1)E-的结构示意图是________________。B原子核外有________个未成对电子,它们的能量______________(填“相等”或“不相等”)。
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为___________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
在中和滴定中,稀盐酸是常用的滴定剂,而盐酸标准溶液的浓度又常常是以氢氧化钠作基准物质标定的,某学生为此进行如下操作:
a.用蒸馏水分别洗净酸式滴定管和锥形瓶,并排出滴定管尖嘴部位的气泡;
b.用待标定盐酸润洗滴定管内壁3次(每次用量2~3 mL);
c.向滴定管内注入待标定盐酸,记录管内液面所在刻度V1 mL;
d.将准确称取的W g干燥的NaOH放入锥形瓶中,加25 mL蒸馏水,振荡使之溶解;
e.滴入1滴酚酞指示剂;
f.在锥形瓶下铺一张白纸,向瓶内滴加待标定的盐酸,边滴边摇动锥形瓶,直到溶液的红色刚好褪去,并不再变红,即为滴定终点;
g.记录滴定管内液面所在刻度V2 mL。
(1)若该生操作无误,则所标定盐酸的物质的量浓度为。
(2)在进行滴定操作时,操作者的眼睛应注视。
(3)若该生在溶解固体氢氧化钠时,用了28 mL蒸馏水,则所标定盐酸的浓度值将
(填“偏高”、“偏低”、“无影响”)。
(4)若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,达滴定终点是平视读数,则所标定盐酸的浓度值将(填“偏高”、“降低”、“无影响”)。
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时,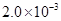 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka=。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),(填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),(填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:
| A.NH4Cl | B.NH4SCN | C.CH3COONH4 | D.NH4HCO3 |
按(NH4+)由大到小的顺序排列是:(填序号)。
按pH由大到小的顺序排列是:(填序号)