合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。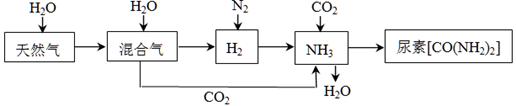
(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染。
已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g)=2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的_____倍(计算结果保留1位小数)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的正极反应式是____ ____。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(4)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为 。
已知: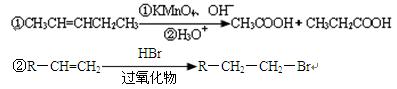
(1)下面是一有机合成反应的流程图: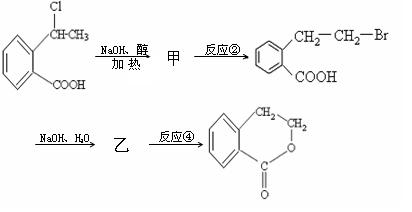
请写出甲与乙的结构简式,甲:乙:
反应②、④的反应类型:、
(2)香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
写出化合物C的结构简式______;芳香内酯A的核磁共振氢谱共有个吸收峰;D的同分异构体中,是苯的对二取代物,且水解后的一种产物能发生银镜反应,请写出其中一种的结构简式:。
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中,
①还原剂是;
②HCl中,被氧化的Cl原子与未被氧化的Cl原子个数比是 。
③若要产生112 mL氯气,则转移的电子数目是。
(2)、(3分)将2.3g钠投入水中,充分反应后,得到的溶液中Na+与水分子的个数比为1:100,则反应所需的m(H2O)="________"
铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答下列问题:(已知Cl2+SO2+2H2O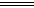 H2SO4+2HCl)
H2SO4+2HCl)
①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变________(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
(1)实验室制取氢氧化铁胶体的化学方程是,可用(方法)证明胶体已经制成。
(2)(4分)下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO B.H2、C、P、Cu
C.O2、Fe、Cu、Zn D.HCl、H2O、H2SO4、HNO3
以上四组物质中与别不同的物质依次是(填化学式)
A;B;C;D。