(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
(4)炼铁和炼钢过程的主要区别是 ;
(5)明矾净化水的原理是
(用离子方程式表示);具有暂时硬度的水中除去Mg2+的方法是 、
(用化学方程式表示)。
下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧 剧烈______________
剧烈______________
(2) MnO2加入双氧水中反应更剧烈______________
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完___________
(4) 镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生________
根据下列叙述,画出对应1--3的微粒结 构示意图:
构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍:。
(2)与Ar原子电子层结构相同的-1价阴离子:。
(3)质量数为23,中子数为12的原子。
(4)写出下列物质的名称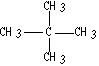 ___________
___________
(5)C5H12的同分异构体有种
(8分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是;
②生成固体C的化学方程式是。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的化学式是;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是;
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。

(1)写出下列物质的化学式;乙;B 。
。
(2)写出3反应的化学方程式。
(3)写出2反应的离子方程式:。
Ⅰ、除去下列物质中所混有的少量杂质,写出有关的反应方程式。
(1)铜粉中混有少量铝粉;
(2) FeCl3中混有少量FeCl2;
(3)Na2CO3固体中混有少量NaHCO3。
Ⅱ、氯气溶于水发生反应,写出其化学方程式。某学生为了探究氯水的成分,请你与他一起完成探究过 程,并书写实验报告。
程,并书写实验报告。
| 实验步骤 |
操作方法 |
实验现象 |
结论或解释 |
| 1 |
观察氯水的颜色 |
含有Cl2 |
|
| 2 |
有无色气体产生 |
含有H+ |
|
| 3 |
取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 |
有白色沉淀生成 |
|
| 4 |
取少量氯水于试管中,放入红色布条 |