(12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A.【物质结构与性质】
氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。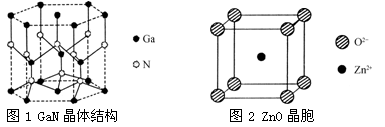
(1)Zn2+基态核外电子排布式为________。
(2)与水分子互为等电子体的一种阴离子是________(填化学式)。
(3)氮化镓(GaN)的晶体结构如图1所示,其中氮原子的杂化轨道类型是________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是________。
(4)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。 不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为________。
(5)某种ZnO晶体的晶胞如图2所示,与O2-距离最近的Zn2+有________个。
(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是 (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 ,产生该气体的原因是 ,总的离子反应方程式为 。
(2)NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
| A.NH2D·H2O和D3O+ |
| B.NH3·D2O和HD2O+ |
| C.NH3·HDO和D3O+ |
| D.NH2D·HDO和H2DO+ |
25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是 ;②若为弱酸强碱盐,其水解的离子方程式是 。
(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是 (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 ,产生该气体的原因是 ,总的离子反应方程式为 。
(2)NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
| A.NH2D·H2O和D3O+ |
| B.NH3·D2O和HD2O+ |
| C.NH3·HDO和D3O+ |
| D.NH2D·HDO和H2DO+ |
水的电离平衡曲线如图所示:
若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。