研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H1 < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H1 < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H2 < 0 (II)
2ClNO(g) K2 ∆H2 < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内 (ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。
试确定A、B、C、D、X各代表何种溶液,把对应物质的化学式填入下列空白:
A:_______,B:________,C:_______,D:_______,X:_______。
草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤.取滤液;③蒸发滤液;④冷却结晶.为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等分:
①取一份溶液,加入适量HCl,观察到 ,证明含有碳酸根。
②取另一份溶液,为检验SO42﹣,应往溶液中先加入过量的 ,再加入BaCl2溶液。
③取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl﹣。你认为所得的结论是否严密? 。理由是 。
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO、Cl-等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程。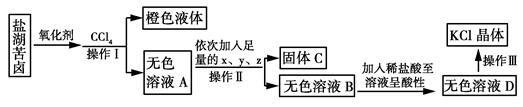
研究性学习小组查寻资料得知:Br-被氧化剂氧化成溴。溴不易溶于水而易溶于CCl4回答以下问题:
(1)操作Ⅰ的名称为________;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有________ 。
(2)试剂x,y,z的化学式分别为x,_______ y z _;检验SO42-已除尽的方法是 。
(3)写出操作Ⅲ的具体操作步骤_____________。
同温同压下,同体积的N2和SO2分子数之比为 ,物质的量之比为 ,原子总数之比为 ,摩尔质量之比为 ,质量之比为 ,密度之比为 。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是 ,如要继续鉴别余下两种,还需要选用的试剂是 ,现象分别为 。