Ⅰ(8分)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为____________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____________(填
“高”或“低”)。
(3)物质中的化学能通过化学反应转化成______释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________
Ⅱ.同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g) ====P4O10(s) ΔH=-2 983.2 kJ·mol-1 ①
P(红磷,s)+  O2(g)="==="
O2(g)="==="  P4O10(s) ΔH=-738.5 kJ·mol-1 ②
P4O10(s) ΔH=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为____________。相同状况下,能量状态较低的是____________;白磷的稳定性比红磷____________(填“高”或“低”)。
(12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)X的电极名称是(填写“阳极”或“阴极”)。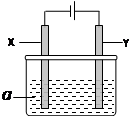
(2)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,
同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近
观察到的现象是,Y极上的电极反应为。
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是,Y电极的材料是。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:2CO(g)+O2(g)==2CO2(g) △H=-566KJ/mol
2H2(g)+O2(g)==2H2O(g) △H=-483.6KJ/mol H2O(g)="=" H2O(l) △H=-44.0KJ/mol
(1)1mol氢气燃烧生成液态水时放出的热为____________
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式_________________________。
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为___________;反应达到平衡后,升高温度,此时平衡常数将___________(填“变大”、“变小”或“不变”),平衡将向__________(填“正”或“逆”)反应方向移动。
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是_______________________________________________。
温度对化学平衡的影响是通过改变_____________________实现的;催化剂对反应速率的影响是通过减小______________实现的。
本题有A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。试回答下列问题:
①Ti元素在元素周期表中的位置是;其基态原子的
电子排布式为。
②偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是;晶体内与每个“Ti”紧邻的氧原子数为个。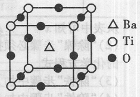
(2)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。已知氰分子中键与键之间的夹角为180。,并有对称性,其结构式为,与CN一互为等电子体的 单质的分子式为。
单质的分子式为。
B.某课题小组同学测量液态奶含氮量的实验过程如下: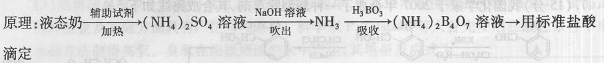
步骤:
①在烧杯中加入10.00mL液 态奶和辅助试剂,加热
态奶和辅助试剂,加热
充分反应;
②将反应液转移到大试管中;
③按右图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);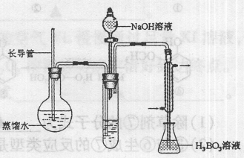
④取下锥形瓶,滴加指示剂,用0.1000mol·L-1盐酸
标准液滴定;
⑤重复测定数次,再用10.00mL蒸馏水代替液态奶进
行上述操作。
数据记录如下:
回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的离子方程式为。
(2)步骤③的实验装置中需要加热的仪器是(填仪器名称),长导管的作用是 。
。
(3)不做空白对照实验对实验结果有何影响(填“无影响”,或“偏高”,或“偏低”)。
(4)计算10.00mL液态奶中的含氮量应代人计算的盐酸体积是mL,该 液态奶的含氮量mg·mL-1。
液态奶的含氮量mg·mL-1。
二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: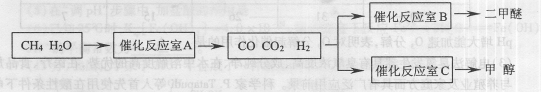
(1)催化反应室B中CO 与H2合成二甲醚的化学方程式为.
与H2合成二甲醚的化学方程式为.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)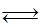 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g)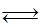 CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g)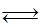 CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为。
×100%,试求反应(Ⅳ)的原子利用率为。
②反应(Ⅳ)的△S 0(填“>”、“=”或“<”)。
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= (用含字母的代数式表示)。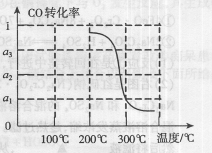
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回 收。
收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。