三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.40g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入适量锌粉使Fe3+全部转化为Fe2+,同时有气泡产生,过滤,洗涤,将过滤及洗涤所得溶液A收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定溶液A至终点,消耗KMnO4溶液21.98ml,反应中MnO4-被还原成Mn2+ 。
重复步骤二、步骤三操作,消耗0.010mol/L KMnO4溶液22.02ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、转移、洗涤、 、摇匀。
②“步骤一”所得溶液的颜色为 。
③写出“步骤二”中加锌粉产生气泡的离子方程式 ;
写出“步骤二”中Fe3+转化为Fe2+的离子方程式 。
④“步骤三”KMnO4溶液应装在 式滴定管中;检查该滴定管不漏水,用水洗净后,装入KMnO4标准溶液前,要对该滴定管进行的操作是 ;
判断滴定至终点依据的现象是 。
⑤实验测得该晶体中铁的质量分数为 。
为了证明一氧化碳具有还原性,有人设计了下列实验: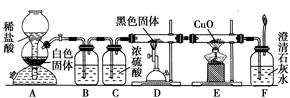
(1)装置B中最适宜的试剂是。
(2)装置D中发生反应的化学方程式是,。
(3)必须用装置C吸收除去气体中水蒸气的理由是,。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置与之间连接下列装置中的(填序号)。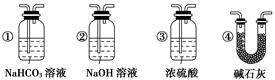
碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu
的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答下列问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+(x+y)H2 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O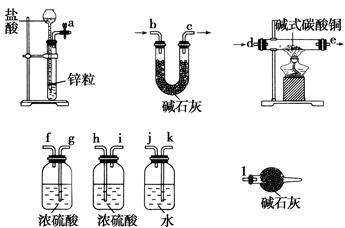
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中
铁元素的含量。实验步骤如下: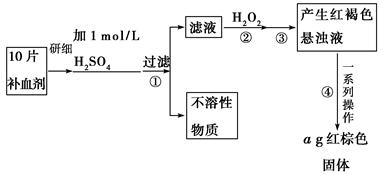
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是:______________________________________。
(3)步骤③中反应的离子方程式是:_______________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
一般测定样品中成分含量的实验应重复2~3次。为了测定某氢氧化钠固体中混有的碳
酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:
Ⅰ.甲同学的方案如图所示:
(1)如何检验A装置的气密性?___________________________________。
(2)甲同学重复进行了三次实验,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能引起测量结果偏低的原因是________(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足、反应不充分
(3)为了让甲的实验测量结果更准确,在其他实验步骤都正确的条件下,你认为图中的实验装置应该如何改进:___________________________________________。
Ⅱ.乙同学的方案是:从图中所提供的装置中选择实验装置,代替甲同学实验装置中的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。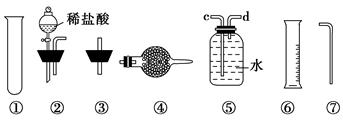
选择最简装置的连接顺序为________。
Ⅲ.丙同学的方案是:称取样品m g,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体n g。
(1)配制100 mL 0.10 mol/L BaCl2溶液的实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外还有______(填仪器名称)。
(2)混合物中碳酸钠的质量分数为(用m、n表示)________。
(3)Ca2+、Ba2+都可以使CO32—沉淀完全,能否使用氯化钙溶液代替氯化钡溶液?________(填“能”或“否”),原因是:______________________________________。
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。