实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是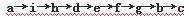 。回答以下问题:
。回答以下问题:
(1)A中加入硫酸溶液的仪器名称是: 。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是 。
(3)E装置的作用是 。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为 。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)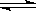 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
升高温度CO2的转化将(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: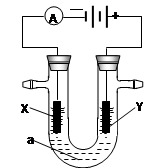
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应为。
在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。
检验该电极反应产物的方法是。
常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示):。
(2)混合溶液中由水电离出的c(H+)(填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)=mol·L-1,c(OH-)-c(HA)=mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列:(填序号)。
在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:
Cr2O72—+H2O 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈色,因为。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈色,
因为。
右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答: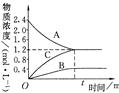
(1)该反应的反应物是。
(2)该反应的化学方程式是:。
(3)若达到平衡状态的时间为2min,则A的平均速率是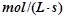 。
。