已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B 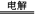 M+D+E;②E+M=A+F+B
M+D+E;②E+M=A+F+B
请回答:
(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法。该化学工业称为 (填字母编号:a.硫酸工 业 b.氯碱工业 c.合成氨工业d.侯氏制碱工业),写出上述反应②的离子方程式为__________ 。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体。则其电解反应方程式是: 。上述两种不同反应中的产物E((1)题)和产物F((2)题)有一种共同的用途是__ ____, 二者反应的离子方程式为______________ __。
下列现象不是由平衡移动引起的是()
| A.氯水光照颜色变浅 |
| B.使用排饱和食盐水的方法收集氯气 |
| C.H2、I2、HI平衡混合气加压颜色变深 |
| D.把有缺陷的胆矾晶体,投入饱和的硫酸铜溶液,一段时间后,晶体变为规则结构。 |
有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1∶1 或2∶1形成化合物;CB可与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出这五种元素的名称:A,B,C,D,E。
(2)画出E的原子结构示意图;
(3)写出电子式D2A2;EB4。
(4)写出D单质与CuSO4溶液总反应的离子方程式。
A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A ,D ,E 。
(2) B、F形成的化合物的电子式 。
(3)A、F两种元素最高价氧化物的水化物之间反应的离子方程式 。
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X |
Y |
Z |
M |
R |
Q |
|
| 原子半径/nm |
0.186 |
0.074 |
0.099 |
0.143 |
||
| 主要化合价 |
-4,+4 |
-2 |
-1,+7 |
+3 |
||
| 其它 |
阳离子核外无电子 |
无机非金属材料的主角 |
焰色反应呈黄色 |
⑴Y在元素周期表中的位置是;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为。
⑵Q的最高价氧化物与Z的最高价氧化物对应的水化物反应的离子方程式是。
⑶Y与R相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是(选填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态 B.稳定性XR >YX4
C.Y与R形成的化合物中Y呈正价
⑷根据表中数据推测,Y的原子半径的最小范围是nm>r(Y)>nm 。
⑸请用电子式表示Z2M的形成过程。
有下列物质:①Cl2②Na2O2③NaOH④HCl⑤H2O2⑥MgF2⑦NH4Cl
(1)属于离子化合物是___________;属于共价化合物是___________;
(2)只由离子键构成的物质是________;
(3)只由极性键构成的物质是________;只由非极性键构成的物质是________;
(4) 由极性键和非极性键构成的物质是______________;
(5) 由离子键和极性键构成的物质是_____________;
(6) 由离子键和非极性键构成的物质是________________。