下图中的几种仪器装置都可以制得氢气,其中: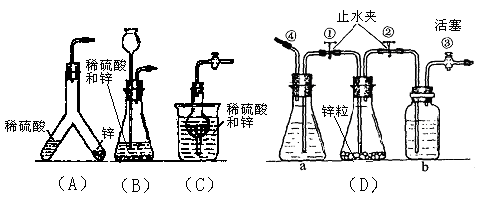
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号) ,能够灌充升空的小氢气球的装置是 。
(2)在(D)装置中a中的液体应是 ;b中的液体应是 ,其作用是 。
(3)使(D)装置发生氢气的操作顺序应该是 。
湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________ 。
(2)浸出液以硫酸锌为主,还含有Fe 3+、Fe 2+、A1 3+、Cu 2+、Cd 2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
① 在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为_________________。
② 将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为__________(填字母)
| A.NaOH | B.NH3·H2O | C.ZnOH | D.H2SO4 |
③ 用Zn除去Cu2+和Cd2+
④ 用Ag2SO4除去Cl一,发生的离子方程式为,__________________。
(3)用两支惰性电极插入500 mL硫酸锌溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),锌在_________极析出,其质量为_________ mg。
苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:
草酸(H2C2O4)为易溶于水的固体
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加人2.7mL甲苯、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5g高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
二、分离提纯
在反应混合物中加入一定量草酸充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取mg产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)装置a的名称是____________,其作用为______________________。
(2)甲苯被高锰酸钾氧化的原理为: 
 ,
,
请完成并配平该化学方程式。
(3)分离提纯过程中加人的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用是_______,请用离子方程式表示反应原理_________________________。
(4)产品减压过滤时用冷水洗涤的原因是________________________。
(5)选用下列__________操作,可以将粗产品进一步提纯。(选填字母)
| A.溶于水后过滤 | B.溶于乙醇后蒸馏 | C.用甲苯萃取后分液 | D.升华 |
(6)测定纯度步骤中,滴定终点溶液的颜色变化是______________。若m=1.200g,滴定时用去0.1200mol· L-1标准KOH溶液20.00mL,则所得产品中苯甲酸的质量分数为_______________。
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电离率。
饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%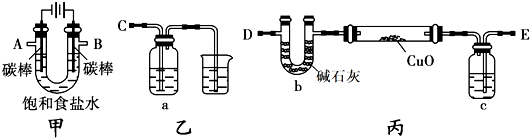
甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的U形管左端的实验现象为________________; 该电解池总反应的化学方程式为________________;
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为__________连_________(填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为________________;
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率。
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与__________口连接(填A、B、C、D、E等导管口)。
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?________(填“同意”或“不同意”)请说明理由 ________________________。
丙方案:只利用甲装置测定饱和食盐水的电解率
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率__________(保留一位小数,假设电解前后溶液体积不变,饱和食盐水密度约为1.33g/mL,溶解度为36.0g)。
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
(1)仪器A的名称____________;

(2) 盐酸的体积读数:滴定前读数为_________mL,滴定后读数为____________ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是___________________(保留四位有效数字) ;
| 实验 编号 |
待测NaOH溶液 的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是______________________________(用序号字母填写);
(5)判断到达滴定终点的实验现象是_______________________________。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 如果上述B步骤省略,对测定结果的影响是_____________________ ;
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是_______________。
工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁(氯化铁遇水能反应);向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
回答下列问题:
(1)检验该装置气密性的方法 。
(2) 制取无水氯化铁的实验中,A中反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
该反应的氧化剂为 ,氧化产物为 。
生成标况下11.2L Cl2时,转移的电子数为 。
(3)制取无水氯化亚铁的实验中,装置A用来制取 。
(4)该装置制取氯化铁时,存在两点明显缺陷,分别是 ;