某温度、压强下,将一定量反应物通入密闭容器进行反应:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);ΔH =" +Q" kJ·mol-1(Q>0),下列叙述正确的是
Si(s)+4HCl(g);ΔH =" +Q" kJ·mol-1(Q>0),下列叙述正确的是
| A.反应过程中,若增大压强,能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D.使用过量的H2或升高温度都可以提高SiCl4的转化率 |
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
| A.1mol | B.0.05mol | C.1.05mol | D.0.11mol |
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是
| A.Fe2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
短周期金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是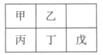
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是
| A.Q1>Q2>Q3 | B.Q1+ Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+ Q2<2Q3 |
下列事实与氢键有关的是
| A.水加热到很高温度都难以分解 |
| B.水结冰体积膨胀,密度减小 |
| C.CH4、SiH4、GeH4、SnH4熔点随分子量增大而升高 |
| D.HF、HCl、HBr、HI热稳定性逐渐减弱 |