超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO = 2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的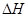 ______0(填写“>”、“<” 或“=”)。
______0(填写“>”、“<” 或“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)该反应的平衡常数K的表达式为K=_________________________;在该温度下,反应的平衡常数的值为____________
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。请在表格中填入剩余的实验条件数据。
| 实验编号 |
T/℃ |
NO初始浓度 mol·L-1 |
CO初始浓度 mol·L-1 |
催化剂的比表面积 m2·g-1 |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
|
|
|
124 |
| Ⅲ |
350 |
|
|
124 |
用中和滴定法测定某烧碱的纯度。
(1)配制待测液
将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要仪器有________________________________________________________________________
________________________________________________________________________。
(2)滴定
①盛装0.200 mol·L-1盐酸标准液应该用__________式滴定管,盛装前对滴定管的要求是:________________________________________________________________________
________________________________________________________________________。
②滴定时,应先向锥形瓶中加________滴__________作指示剂;滴定过程中两眼应注视________________________,当_______________________________时为滴定终点。
③有关数据记录如下:
| 滴定序号 |
待测液体体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| ① |
20.00 |
0.50 |
20.70 |
| ② |
20.00 |
6.00 |
26.00 |
(3)纯度计算
NaOH溶液的浓度为__________mol·L-1,烧碱样品的纯度为__________。
(4)对几种假定情况的讨论
①若用蒸馏水冲洗锥形瓶,则会使测定结果______;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果__________;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________。(以上均填“偏低”、“偏高”或“无影响”)
某同学测定镀锌铁皮锌镀层厚度,步骤如下:
(1)测量三块镀锌铁皮的长度与宽度,记录数据。
(2)用电子天平分别测量三块镀锌铁皮的质量。
(3)将镀锌铁皮放入烧杯中,加入盐酸,反应时应小心将铁片翻动,该操作的目的是________________________________________________________________________。
若没有此类操作,则测得的锌镀层厚度
________________________________________________________________________。
当反应速率显著减小时,立即取出铁片并
________________________________________________________________________,
该操作的目的是
________________________________________________________________________。
(4)将铁片放在石棉网上,用小火烘干,该操作的目的是______________________________。若不烘干,则计算得到的锌镀层厚度结果将____________。若改用酒精灯持续加强热,则会造成________________________________________________________________________。
(5)根据实验数据,完成下表,求出镀锌铁皮的锌镀层厚度(锌的密度取7.14 g·cm-3)。
| 数据记录 |
数据处理 |
||
| 镀锌铁皮A长4.94 cm、宽4.90 cm 镀锌铁皮B长5.05 cm、宽5.00 cm 镀锌铁皮C长5.05 cm、宽4.90 cm 镀锌铁皮A m1(A)=2.455 g 镀锌铁皮B m1(B)=2.508 g 镀锌铁皮C m1(C)=2.500 g 镀锌铁皮A m2(A)=2.201 g 镀锌铁皮B m2(B)=2.247 g 镀锌铁皮C m2(C)=2.238 g |
镀锌铁 皮编号 |
镀锌铁 皮厚度 (单侧) /cm |
镀锌铁 皮平均 厚度(单 侧)/cm |
| 镀锌 铁皮A |
|||
| 镀锌 铁皮B |
|||
| 镀锌 铁皮C |
已知Zn(OH)2能溶于NaOH溶液转变成Na2[Zn(OH)4]。为了测定某白铁皮中锌的质量分数,进行如下实验:取a g白铁皮样品于烧杯中,加入过量稀盐酸,用表面皿盖好,开始时产生气泡的速度很快,以后逐渐变慢。待试样全部溶解后,向烧杯中加入过量NaOH溶液,充分搅拌后过滤,将所得沉淀在空气中加强热至质量不变,称得残留固体质量为b g。
(1)白铁皮镀锌的目的是
________________________________________________________________________。
(2)气泡产生速度先快后慢的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)溶液中加入过量NaOH溶液,发生反应的离子方程式是(不是离子反应的写化学方程式):
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________。
(4)最后残留的固体是__________,得到该固体的化学反应方程式是
________________________________________________________________________。
(5)白铁皮含锌的质量分数是______________(用含a、b的式子表示)。
饮料果醋中含有苹果酸,苹果酸经聚合生成聚苹果酸。已知:
a、0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况);
b、 苹果酸脱水生成能使溴水褪色的产物;
c、RCH2Br RCH2COOH 。
RCH2COOH 。
d、RC≡CH+R’CHO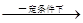 RC≡CCH-OH
RC≡CCH-OH
R’

请回答:
(1)写出B的结构简式。
(2)写出苹果酸所含官能团的名称, F转化成苹果酸可能发生的反应类型。
(3)写出与苹果酸具有相同官能团的同分异构体的结构简式。
(4)写出F与足量银氨溶液反应的化学方程式。
(5)写出C与NaOH溶液反应的化学方程式。
(6)聚苹果酸具有良好的生物相容性,可作为手术缝合线等材料应用于生物医药和生物材料领域。其在生物体内水解的化学方程式。
利用芳香烃X和烯烃Y(分子式C3H6)可以合成紫外线吸收剂BAD,BAD的结构简式为:
已知G不能发生银镜反应。BAD的合成路线如下: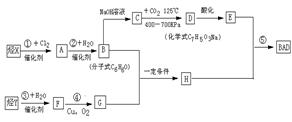
试回答下列问题
(1)写出结构简式:Y ;D 。
(2)属于取代反应的有 (填数字序号)。
(3)1 mol BAD最多可与含 mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④:
B+G→ H:
反应⑤: