A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图 。
(2)在1mol DC2中,有 mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有 个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是 (填元素符号),三种10e-的化合物中沸点最低的 。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是 。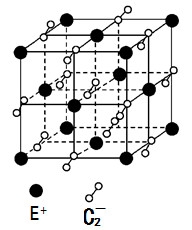
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
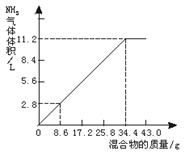
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140 mL,固体混合物的质量是51.6 g时,充分反应后,生成气体的体积(标准状况)为________ L。
(3)当NaOH溶液的体积为180 mL,固体混合物的质量仍为51.6 g时,充分反应后,生成气体的体积(标准状况)为________ L。
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2)
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO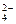 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:。
某化学反应2A===B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·(L·min)-1。
(2)在实验2,A的初始浓度c2=__________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”“=”或“<”=,且c3__________1.0 mol·L-1(填“<”“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。理由是 。
(1)铀主要以三种同位素的形式存在,三种同位素的原子百分含量分别为: U 0.005%、
U 0.005%、 U 0.72%、
U 0.72%、 U 99.275%。请列出计算U元素近似原子量的计算式(不必算出具体数值):___________。
U 99.275%。请列出计算U元素近似原子量的计算式(不必算出具体数值):___________。
(2)放射性同位素40Co能够产生γ射线。高速运动的γ射线作用于DNA,能够产生氢键断裂、碱基替换等效应,从而有可能诱发生物产生___________,使生物体出现可遗传的变异,从而选择和培育出优良品种。此外用γ射线照射过的食品有利于贮藏,这是因为γ射线能___________。在进行照射生物或食品的操作时,需要注意人体防护。操作完毕后,人体___________ (可以、不可以)直接触摸射线处理过的材料。
Zn+2MnO2+2NH ===Zn2++Mn2O3+2NH3+H2O
===Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:___________负极:___________
干电池用久了就会变软,其原因是____________________________________________。
(2)正极反应中,前后经历了下列两个反应:
2NH +2e-===2NH3+H2
+2e-===2NH3+H2
2MnO2+H2===Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由。
(3)在通电10 min的时间内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
(4)许多国家对废旧电池进行回收,从保护环境和节约能源解释为什么要回收废旧电池。