常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是 ( )
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度: c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
当光束通过豆浆时可观察到丁达尔效应,表明豆浆是()
| A.胶体 | B.溶液 | C.悬浊液 | D.乳浊液 |
下列关于元素周期表的叙述,不正确的是
| A.共有7个周期,16个族 |
| B.形成化合物种类最多的元素在第二周期 |
| C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 |
| D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):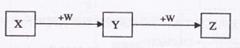
下列说法不正确的是
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
B.若W是氢氧化钠 ,则X与Z可反应生成Y ,则X与Z可反应生成Y |
| C.若X是碳酸钠,则W可能是盐酸 |
| D.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸 |
关于下列各装置图的叙述中,正确的是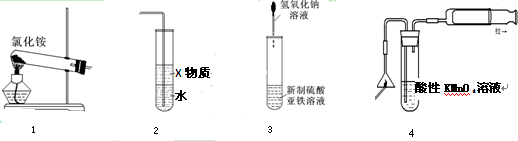
| A.实验室用装置①制取氨气 |
| B.装置②中X若为苯,可用于吸收氨气或氯化氢,并防止倒吸 |
C.装置③可用 于制备氢氧化亚铁 于制备氢氧化亚铁 并观察其颜色 并观察其颜色 |
| D.装置④可用于检验火柴头燃烧产生的SO2 |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述:
①离子半径:Na+>N3->H+;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
| A.②③④⑤ | B.①③⑤ | C.②④ | D.③ |