一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
①、若为定容容器,n(NH3)=1.2mol ②、若为定容容器,n(NH3)>1.2mol
③、若为定压容器,n(NH3)=1.2mol ④、若为定压容器,n(NH3)<1.2mol
| A.只有②③ | B.只有①③ | C.只有①④ | D.只有②④ |
某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c (Na+) = 4×10—4 mol/L,c (SO42—) = 2.5×10—4 mol/L,c (Cl—) = 1.6×10—5 mol/L,c (NO3—) = 1.4×10—5 mol/L,c (Ca2+) = 1.5×10—5 mol/L,则该废水的pH为__________。
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+2c(OH-) = 2c(H+) + c(CH3COO-)
D.0.1 mol/L的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2—)
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是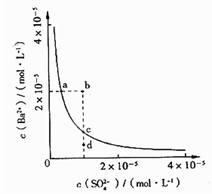
提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数 Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数 Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
准确量取25.00毫升高锰酸钾溶液,可选用的仪器是
| A.50 mL量筒 | B.25 mL量筒 |
| C.50 mL碱式滴定管 | D.50 mL酸式滴定管 |
下列叙述正确的是
| A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH = 3的醋酸溶液,稀释至10倍后pH = 4 |
| C.0.2 mol·L-1的盐酸,与等体积水混合后pH = 1 |
| D.pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7 |