控制适当的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )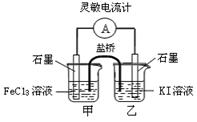
| A.反应开始时,乙中电极反应为2I--2e-= I2 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.平衡时甲中溶入FeCl2固体后,电流计读数为零 |
下列溶液一定呈酸性的是
| A.c(OH-)<c(H+)的溶液 | B.含有较多H+的溶液 |
| C.pH<7的溶液 | D.能与金属Al反应放出H2的溶液 |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
①混合气体的密度②容器内气体的压强③混合气体的总物质的量
④C物质的量浓度⑤混合气体的平均相对分子质量⑥B的转化率
| A.①④⑤⑥ | B.只有④ | C.②③④ | D.全部 |
反应N2(g)+3H2(g) 2NH3(g) △H<0已达到平衡,只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
2NH3(g) △H<0已达到平衡,只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.K值不变,平衡可能移动 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn-2e-+2OH-= Zn(OH)2 Ag2O +H2O + 2e-= 2Ag+2OH-
下列说法正确的是
| A.溶液中OH-向正极移动,K+、H+向负极移动 |
| B.锌发生还原反应,氧化银发生氧化反应 |
| C.锌是负极,氧化银是正极 |
| D.在电池放电过程中,负极区溶液碱性增强 |
关于下列各装置图的叙述不正确的是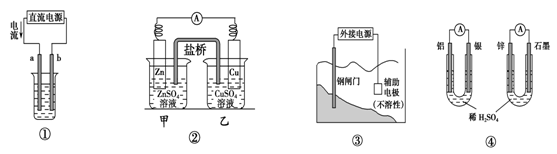
| A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B.图②装置的盐桥中KCl的Cl-移向乙烧杯 |
| C.图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |