某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。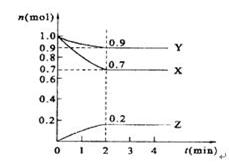
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ,
(4)当反应进行到第 min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为______。
A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR’在酸性高锰酸钾溶液中反应生成RCOOH和R’COOH,其中R和R’为烷基)。
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为_▲;B的结构简式是_▲
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是▲,反应类型为_▲:
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是▲
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有▲种,其相应的结构简式是▲
(1)苏合香醇可以用作食用香精,其结构简式如图所示。
苏合香醇的分子式为,它不能发生的有机反应类型有(填数字序号)。
①取代反应 ②加成反应 ③氧化反应 ④加聚反应
(2)苏合香醇属于酚类有机物的同分异构体共有种
(3) 的同分异构体有多种,满足下列条件的共有种。
的同分异构体有多种,满足下列条件的共有种。
① 苯环上只有两个取代基
② 1 mol 与足量的NaHCO3溶液反应生成2 mol CO2气体
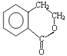
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂。它的结构简式如右图所示,请回答:
(1) A的分子式是 ▲ 。
(2) 有机物A不能发生的化学反应有(填序号) ▲ 。
a.加成反应 b.水解反应
c.加聚反应 d.氧化反应
(3)满足下列条件的A的同分异构体有▲种,写出其中一种的结构简式▲。
①能与碳酸氢钠溶液反应;
②核磁共振氢谱显示有四种类型氢原子的吸收峰
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D 三种物质。
,它可通过不同化学反应分别制得B、C和D 三种物质。

B C D
(1)B中的含氧官能团名称是 ▲、▲ 。
(2)C→A的反应类型是 ▲;A~D中互为同分异构体的是 ▲ 。
(3)由A生成B的化学方程式是 ▲ 。
(4)C在一定条件下发生加聚反应的化学方程式是 ▲ 。
下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法。填表(填入序号):
B:(1)CaO;(2)NaOH溶液;(3)溴水; (4)饱和Na2CO3;(5)水
C:(1)重结晶;(2)洗气;(3)蒸馏(4)分液。
| 物质 |
加入试剂 |
操作方法 |
| ①粗苯甲酸的提纯 |
▲ |
▲ |
| ②乙醇(水) |
▲ |
▲ |
| ③乙酸乙酯(乙酸) |
▲ |
▲ |
| ④乙烷(乙烯) |
▲ |
▲ |
| ⑤苯(酒精) |
▲ |
▲ |