关于 Na2 CO3和NaHCO3下列说法不正确的是( )
| A.可以用加热的方法除去Na2 CO3中的NaHCO3 |
| B.分别向Na2 CO3和NaHCO3溶液滴加少量盐酸,产生CO2气体较快的为NaHCO3 |
| C.可以用Ca( OH)2溶液区分Na2 CO3和NaHCO3溶液 |
| D.Na2 CO3比NaHCO3易溶于水 |
已知在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是()
| A.加入纯Cu将Fe2+还原为Fe |
| B.向溶液中通入H2S使Fe2+沉淀 |
| C.向溶液中通入Cl2,再通入NH3,调节pH值为4~5 |
| D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4~5 |
对水的电离平衡不产生影响的粒子是( )
A.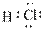 |
B.26M3+ | C.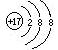 |
D.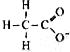 |
干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
| 物 质 |
MgO |
CaO |
ZnCl2 |
ZnBr2 |
| 干燥效率 |
0.008 |
0.2 |
0.8 |
1.1 |
根据以上数据,下列有关叙述错误的是()
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4  Cu。
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是()
| A.相等 | B.①多 | C.②多 | D.无法判断 |
下列判断正确的是()
A.25℃ 时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa等体积混合,溶液呈酸性:c(CH3COO-)+ c(OH-)<c(CH3COOH)+ c(H+) 时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa等体积混合,溶液呈酸性:c(CH3COO-)+ c(OH-)<c(CH3COOH)+ c(H+) |
| B.相同条件下,2mol氯原子所具有的能量小于1mol氯分子所具有的能量 |
| C.0.1 mol/L的碳酸钠溶液的pH大于0.1 mol/L的醋酸钠溶液的pH |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(H+)==c(OH¯) |