甲、乙、丙三种元素均位于第三周期,其原子序数逐渐增大,甲的最高价氧化物对应的水化物是强碱,乙是地壳中含量最多的金属元素,丙是本周期中原子半径最小的元素。下列说法不正确的是
| A.甲是第IA元素,丙是第VIIA元素 |
| B.甲、丙形成的化合物是离子化合物 |
| C.乙的最高价氧化物是两性氧化物 |
| D.丙是元素周期表中非金属性最强的元素 |
在水溶液中能大量共存的一组离子是
| A.S2—、Al3+、ClO-、Cl- | B.K+、Mg2+、OH-、NO3- |
| C.H+、Mg2+、SiO32-、SO42- | D.NH4+、Na+、Cl-、SO42- |
下列有关常见有机物说法正确的是
| A.乙烯、苯、纤维素均属于烃类化合物 |
| B.天然氨基酸能与强酸或强碱溶液反应 |
| C.石油的蒸馏、裂化属于化学变化 |
| D.油脂、聚氯乙烯均属于高分子化合物 |
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍。下列判断正确的是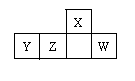
| A.原子半径:X>Y>Z>W |
| B.含Y元素的盐溶液有的显酸性,有的显碱性 |
| C.最简单气态氢化物的热稳定性:Z >W |
| D.X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
下列说法不正确的是
| A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.常温下,浓度均为0.1 mol·L-1下列各溶液的pH:NaOH>Na2CO3> NaHCO3> NH4Cl |
| C.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小 |
| D.常温下,pH=1的稀硫酸与醋酸溶液中,c(SO42-)与c(CH3COO-)之比为2∶1 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标况下,11.2L乙烷中含有共价键的数目为3NA |
| B.标况下,22.4LO2和CO2组成的混合物中含有氧原子数为2NA |
| C.常温下,22.4L甲烷中含有的电子数为10NA |
| D.常温下,1 L 0.1mol·L-1的Na2CO3溶液中含OH-离子数为0.1NA |