草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是
| A.c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + c (C2O42-) |
| B.c (C2O42-) < c (H2C2O4) |
| C.c (HC2O4-) + c (C2O42-) =" 0.1" mol·L-1 |
| D.c (K+) =" c" (H2C2O4) + c (HC2O4-) + c (C2O42-) |
在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可看到灰黑色粉末,其中有些已变成棕褐色。将灰黑色粉末溶于盐酸,得浅绿色溶液。取上层清液滴入几滴氯水,再滴入KSCN溶液后溶液马上出现血红色。以下结论不正确的是
| A.该灰黑色粉末作抗氧化剂 |
| B.该灰黑色粉末不可食用 |
| C.小袋中原来装有铁粉 |
| D.小袋中原来装有Fe2O3 |
许多小溪流经硫矿和金属矿,由于含硫矿暴露在空气中或暴露在含氧的水中,这些小溪变成酸性,溪水中含有溶解的铁和硫酸盐,它们的浓度都很高。最常见的含硫矿是黄铁矿(FeS2),其中铁的化合价为+2;当富铁的溪水和其他水混合时,溶于水的铁以针铁矿[FeO(OH)]的形式沉淀出来,覆盖在小溪的底部,而水仍保持酸性。反应的离子方程式为4Fe2++O2+6H2O===4FeO(OH)↓+xH+,则该离子方程式中H+的化学计量数x为
| A.5 | B.6 | C.7 | D.8 |
某溶液中含MgCl2和AlCl3各0.01 mol,向其中逐滴滴加1 mol·L-1的NaOH溶液至过量,下列关系图正确的是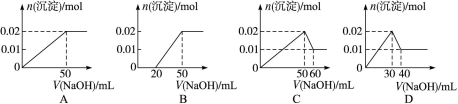
用一张已除去表面氧化膜的铝箔紧紧包裹在试管的外壁(如图),把试管浸入到硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
| A.此实验中发生的反应都是氧化还原反应 |
| B.铝是一种较活泼的金属 |
| C.铝与氧气反应放出大量的热量 |
| D.铝片上生成的白毛是氧化铝和氧化汞的混合物 |
下列有关铝的说法正确的是
| A.金属铝与盐酸或氢氧化钠溶液分别反应均产生0.2 mol氢气时,失去的电子数不同 |
| B.铝既能与盐酸反应(生成AlCl3),又能与NaOH溶液反应(生成NaAlO2),所以金属铝具有两性 |
| C.金属铝能在空气中形成一层致密的氧化膜,因此是一种比较活泼的金属,所以将少量铝投入到过量的FeCl3溶液中,可以置换出金属铁 |
| D.铝元素在人体内聚集过多,对健康不利,建议尽量少用铝制餐具、铝制食品包装袋、铝制易拉罐等 |