合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%。最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2→2NH3,有关说法正确的是
| A.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 |
| C.新法合成能在常温下进行是因为不需要断裂化学键 |
| D.新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |
如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是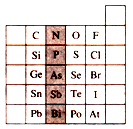
| A.N元素为第一周期元素 |
| B.PH3的稳定性比H2S强 |
| C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4 |
| D.H3AsO4的酸性比H3PO4弱 |
A元素原子核电荷数为11,B元素原子的质子数为8,A和B可形成化合物Z,下列说法中错误的是
| A.A形成 +1价阳离子 | B.Z一定能与水反应 |
| C.Z中只能含有离子键 | D.Z的熔点较高 |
下列反应中,产生氢气速度最快的是
| A.常温下铝与6mol/L的硝酸 | B.常温下镁与3mol/L的醋酸 |
| C.常温下铁与3mol/L的盐酸 | D.常温下镁与3mol/L的硫酸 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是
| A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B.将大小、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面哪项不是其主要目的
| A.节约原料和能源 | B.提高产品的产量 |
| C.提高经济效益 | D.提高化学反应速率 |