铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图: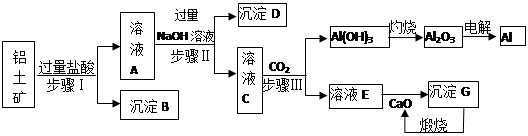
(1)沉淀B的化学式为 ,溶液A中含的阳离子主要有 。
(2)写出步骤II生成溶液C 的离子方程式 ,
步骤I、II、III都要用到的分离方法是 。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有: (填化学式)。
(4)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数) (用含a、b的最简式表示)。
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2= 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式。
(2)B中观察到的主要现象是有无色气体产生和,D装置的作用是。
(3)检验C中产物有亚硝酸钠的方法是。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称。
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭g。
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: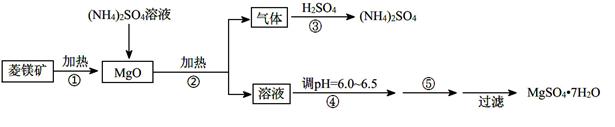
(1)步骤②中发生反应的离子方程式为。
(2)步骤④中调节pH=6.0~6.5的目的是。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式:。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤 |
预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
| 步骤2: ____________________________________ ____________________________________。 |
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水,。
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是, 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式:;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为,滤液B可以回收的物质有Na2SO4、MgSO4和___________;
(4)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为(用最简分数表达式表示)。
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是。
(2)将a中的溶液加热至100 ℃,从b中缓缓滴加40 g苯乙腈( )到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称是,反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称是,反应结束后加适量冷水,再分离出苯乙酸( )粗品。加人冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
)粗品。加人冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是,最终得到44 g纯品,则苯乙酸的产率是。
(4)用CuCl2 • 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是。