下列反应的离子方程式书写正确的是
| A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+ |
| B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+==Ca2++CO2↑+H2O |
| C.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+==NO↑+I2+H2O |
| D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液 |
NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
质量都为4.2 g的A气体和B气体,在标准状况下的体积分别为3.36 L和2.24 L,则这两种气体的摩尔质量之比为( )
| A.1∶1 | B.1∶3 | C.3∶2 | D.2∶3 |
24mL浓度为0.05mol/L 的Na2SO3溶液恰好与20mL浓度为0.02 mol/L的K2Cr2O7溶液完全反应;已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )
| A.+2 | B.+3 | C.+4 | D.+5 |
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )
A. |
B.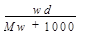 |
C. |
D.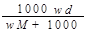 |
在xR2+ + yH+ +O2 = mR3+ + nH2O的离子方程式中,对化学计量数m 和R2+、R3+判断正确的是
| A.m="y," R3+是还原剂 | B.m="2y," R2+被氧化 |
| C.m="2," R3+是氧化剂 | D.m="4," R2+是还原剂 |
下列离子方程式,正确的是( )
| A.氢氧化铁与盐酸反应:H++OH-= H2O |
| B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O |
| C.铁与盐酸反应:2Fe+6H+= 2Fe3++3H2↑ |
| D.CaCO3溶于稀盐酸中:CO32-+2H+= CO2↑+H2O |