一般情况下,前者无法决定后者的是( )
| A.原子核外电子排布——元素在周期表中的位置 |
| B.化合物熔融状态是否导电——化合物是否为离子化合物 |
| C.分子间作用力的大小——分子稳定性的强弱 |
| D.物质内部储存的能量高低——化学反应的热效应 |
0.02 mol/L HCN溶液与0.02 mol/L NaCN溶液等体积混合,已知混合溶液c(CN-)<c(Na+),
则下列关系正确的是
| A.c(Na+)>c(CN-)>c(OH-)>c(H+) | B.c(HCN)+c(CN-)=0.04 mol/L |
| C.c(OH-)=c(H+)+c(HCN) | D.c(CN-)>c(HCN) |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是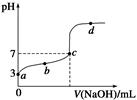
| A.a点表示溶液中c(CH3COO-)=10-3 mol/L |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中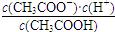 均等于K 均等于K |
下列根据反应原理设计的实际应用不正确的是
A.CO32-+H2O 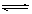 HCO3-+OH-;用热的纯碱溶液清洗油污 HCO3-+OH-;用热的纯碱溶液清洗油污 |
B.A13++3H2O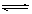 Al (OH)3(胶体)+3H+;明矾净水 Al (OH)3(胶体)+3H+;明矾净水 |
| C.A13++3HCO3-=Al (OH)3↓+3CO2↑;泡沫灭火器灭火 |
D.SnCl2+H2O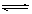 Sn( OH)Cl↓+HCl ;配制氯化亚锡溶液时加入氢氧化钠溶液 Sn( OH)Cl↓+HCl ;配制氯化亚锡溶液时加入氢氧化钠溶液 |
用铜片、银片、Cu(NO3) 2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型管)构成一个原电池(如图)。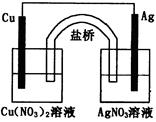
以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag+ + e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
下列叙述不正确的是
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原因是增加了活化分子的百分数 |
| C.某化学反应的能量变化如上图所示,则该反应的△H>0,△S>0 |
| D.H3PO4的电离常数:K1>>K2>>K3 |