用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解质溶液的pH下降的是( )
| A.CuCl2 | B.H2SO4 | C.NaCl | D.AgNO3 |
常温下,下列各组离子在制定溶液中一定能大量共存的是
| A.1.0mol/L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表是一些化学键的键能。
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能/(kJ·mol-1) |
414 |
489 |
565 |
155 |
根据键能数据估算下列反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为
A.-1940kJ·mol-1 B.1940kJ·mol-1 C.-485kJ·mol-1 D.485kJ·mol-1
右图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述不正确的是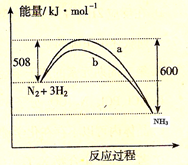
A.该反应的热化学方程式为:N2(g) + 3H2(g) 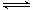 2NH3(g), △H = -92kJ·mol-1 2NH3(g), △H = -92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的活化能和反应热都改变 |
| D.在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2molN2和6molH2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
在同温同压下,下列各组热化学方程式中 Q1 <Q2的是(反应条件已略去)
| A.2H2(g) + O2(g) = 2H2O(g) ;△H=-Q1 , 2H2(g) + O2(g) = 2H2O(l) ;△H=-Q2 |
| B.S(g) + O2(g) = SO2(g) ;△H=-Q1 , S(s) + O2(g) = SO2(g) ;△H=-Q2 |
| C.C(s) + 1/2O2(g) =" CO(g)" ;△H=-Q1 , C(s) + O2(g) = CO2(g) ;△H=-Q2 |
| D.H2(g) + Cl2(g) =" 2HCl(g)" ;△H=-Q1 , 1/2H2(g) + 1/2Cl2(g) =" HCl(g)" ;△H=-Q2 |
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
| A. c(H+) | B.Ka(HF) | C.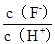 |
D. |