甲、乙、丙、丁、戊为短周期原子序数依次增大的五种主族元素。乙、戊同主族,甲与乙的原子序数之和等于戊的原子序数。丙是短周期主族元素中原子半径最大的元素,丁元素在地壳中含量居金属元素的第一位。下列说法正确的是
| A.简单离子半径:丁>丙>乙>甲 |
| B.气态氢化物的稳定性:甲>乙 |
| C.甲与丙形成的化合物仅有一种 |
| D.丙、丁、戊的最高价氧化物对应的水化物之间两两均能反应 |
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
| D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈 |
在平衡体系2NO+O2 2NO2中通入18O组成的氧气,重新达到平衡后,则18O
2NO2中通入18O组成的氧气,重新达到平衡后,则18O
| A.只存在于O2中 |
| B.只存在于NO2中 |
| C.只存在于O2和NO2中 |
| D.存在于NO、O2、NO2 |
今有如下三个热化学方程式:
H2(g)+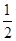 O2(g)=H2O(g);△H=" a" kJ/mol
O2(g)=H2O(g);△H=" a" kJ/mol
H2(g)+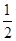 O2(g)=H2O(l);△H=" b" kJ/mol
O2(g)=H2O(l);△H=" b" kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H=" c" kJ/mol
关于它们的下列表述,正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
下列物质属于强电解质且能导电的是
①氯化钠溶液②氯化铵固体③铜④石墨⑤熔融NaOH⑥稀硫酸⑦乙酸
| A.⑤ | B.①②⑥ |
| C.②⑤⑥⑦ | D.①③④⑤⑥ |
ClO2是一种消毒杀菌效率高、污染小的水处理剂。实验室可通过以下反应制得ClO2。2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
| A.KClO3在反应中是还原剂 |
| B.1 mol KClO3参加反应,在标准状况下能得到22.4 L气体 |
| C.在反应中H2C2O4既不是氧化剂也不是还原剂 |
| D.1 mol KClO3参加反应有1 mol电子转移 |