为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:pb(s)+pbO2(s)+2H2SO4(aq)=2pbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是 
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a的电极反应式为:4OH—―4e—=O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况) |
按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量。下列叙述正确的是 
| A.F表示反应生成Cu的物质的量 |
| B.E表示反应消耗H2O的物质的量 |
| C.E表示反应生成O2的物质的量 |
| D.F表示反应生成H2SO4的物质的量 |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是()
A、 若溶液中c(A-)=c(Na+),则溶液一定呈中性
B、 溶液中不可能存在:c(Na+)> c(A-)> c(H+)> c(OH-)
C、 若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D、 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
如下图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:t1时刻断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,t2时刻断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是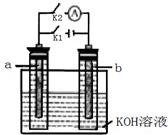
| A.t1时刻开始断开K2,闭合K1一段时间,溶液的pH要变大 |
| B.t2时刻断开K1,闭合K2时,b极上的电极反应式为:2H++2e—= H2↑ |
| C.t1时刻断开K2,闭合K1时,a极上的电极反应式为:4OH—―4e—=O2↑ +2H2O |
| D.t2时刻断开K1,闭合K2时,OH-向b极移动 |
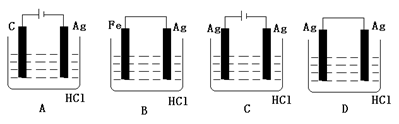
某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是