按下列要求自制铜-镁简易电池,并回答有关问题。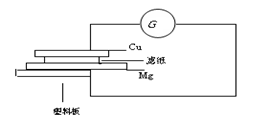
a.用砂纸擦净一块铜片和镁条。
b.用盐酸溶液浸湿一张滤纸,把浸湿的滤纸放在镁条上。
c.把滤纸和镁条并放在一块塑料板上。
d.把镁条连接到电流计的一个端钮
e.把铜片压在滤纸上。
f.把铜片连接到电流计的另一个端钮。
g.观察电流表指针变化。
请回答下列问题。
(1)在以上简易电池中, 是负极,电极反应式
是正极,电极反应式
(2)在以上电池中,电子由 经 流向
已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
①向氨水中加入MgCl2固体时,平衡_______(向正反应、向逆反应、不)移动,OH-的浓度_______(减小、增大、不变,下同),NH4+的浓度_______。
②向氨水中加入浓盐酸,平衡_______(向正反应、向逆反应、不)移动,此时溶液中浓度增大的离子有(Cl-除外)___________。
(4分)实验室配制500ml 0.1mol/LNA2CO3溶液,在转移溶液时,需要的仪器除了烧杯玻璃棒外,还需要____________(填仪器名称),若遗漏了“洗涤”步骤,则会使制得的溶液浓度___________(偏大,偏小,无影响)
(14分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: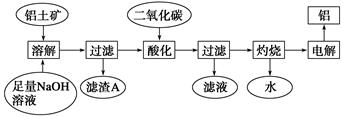
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②除硅的方法:溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
回答下列问题:
(1)Al元素在元素周期表中的位置为 ;电解制取Al的化学反应中,反应物总能量 生成物总能量(填“大于”、“等于”或“小于”);二氧化碳的结构式为 。
(2)写出向Al2O3与氢氧化钠溶液发生反应的离子方程式 _____。
(3)滤渣A的主要成分为__________________________。
(4)在工艺流程第三步中,通入过量二氧化碳的化学反应方程式是_______________________。
(5)实验时取铝土矿ag,经过上述工艺流程最后得到bgAl,则铝土矿中的Al2O3质量分数为 。
| A.=102b/54a | B.>102b/54a | C.<102b/54a | D.均有可能 |
(10分)CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+1/2O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______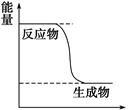
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=,则CH3OH的转化率为。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是。
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-==CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2 mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为_____________________。
某温度下,在2 L密闭容器中X、Y、Z三种气体进行反应, 其物质的量随时间的变化曲线如图。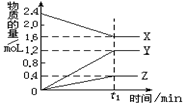
(1)该反应的化学方程式是_____________________。
(2)若t1= 2min, 用X表示0-t1时间段的反应速率为___,X的转化率为 _________
(3)在t1 min时,该反应达到了化学平衡状态,下列可作为反应已达到平衡状态标志的是()(填字母序号)
| A.X、Y、Z的反应速率相等 |
| B.生成3 mol Y的同时生成1 mol Z |
| C.生成1 mol Z的同时生成2 mol X |
| D.容器的压强保持一定 |
E.容器内气体的平均相对分子质量不再改变