某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是
Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
(1)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是
;
;
第③步中,生成氢氧化铝的离子方程式是
。
(2)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
(3)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol电子,反应的化学方程式是 。
蛋白质是日常生活中人类必须的六大营养素之一,向两支盛有蛋白质溶液的试管中分别加入一定量的饱和硫酸铵溶液和硫酸铜溶液时都会出现沉淀,这两个作用过程被分别称为和,区别两种作用的简单方法是。
尿嘧啶(U)是核酸中的一种碱基。它由C、H、O、N四种元素组成,其球棍模型如右图所示。由此推断,尿嘧啶可能发生的反应有(填编号)。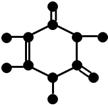
①水解②加聚③酯化④消去⑤银镜⑥还原
沉淀溶解平衡也有平衡常数,称为溶度积常数,符号为Ksp,对于某沉淀溶解平衡:
MmAn(s) mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp=。(写出计算过程)
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) |
0 |
2 |
4 |
| c(NO) ( mol·L-1) |
1.00×10-3 |
2.50×10-4 |
1.00×10-4 |
| c(CO) ( mol·L-1) |
3.60×10-3 |
c’ |
2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)=。c’=。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。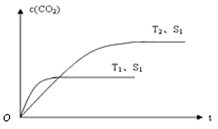
①该反应的ΔH0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是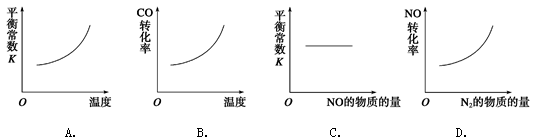
回答下列问题。
(1)常温时,FeCl3溶液的pH7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是,该溶液中四种离子的浓度由大到小的顺序为。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显(填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。