芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示:
(1)F中含氧官能团的名称是 ;B→A的反应类型是 。
(2)H的结构简式是 。
(3)写出下列化学方程式:D与银氨溶液反应 。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由是 。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
在适宜的条件下,由CH2===CH2分子可自身相互加成而生成高分子化合物——聚乙烯,其化学反应方程式为,反应类型为。
在铝热反应 Fe2O3 + 2 Al  2 Fe + Al2O3中,作为氧化剂的物质是__(填化学式),作为还原剂的物质是(填化学式);
2 Fe + Al2O3中,作为氧化剂的物质是__(填化学式),作为还原剂的物质是(填化学式);
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)=mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________
化学计量在化学中占有重要地位,请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与个H2O分子中所含原子数相等。
(2)含0.4 mol A13+的Al2(SO4)3中所含的SO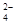 的物质的量是 _____。
的物质的量是 _____。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 ____________。
(4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是______________。
(5)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,则 c(SO42-)="___________" 。
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
从实验可以判断,该固体粉末中(1)一定不含有,
(2)它的组成可能是或。
(3)加入盐酸后发生反应的离子方程式为 。
(4)要进一步确定其组成还应进行的实验操作是。