已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。
| |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入氢氧化钠溶液的质量/g |
25 |
25 |
25 |
25 |
| 生成沉淀的质量/g |
2.9 |
x |
8.7 |
8.7 |
(1)表中x = 。
(2)样品中氯化镁的质量分数是 。
(3)若实验室中只有80g质量分数为30%的氢氧化钠溶液,要想配成本实验所需溶质质量分数的氢氧化钠溶液,还需加入水的质量是多少?
将一块锌铜合金投入74.2g稀H2SO4中,恰好完全反应,生成氢气0.2g。求:
(1)求锌铜合金中锌的质量;
(2)反应后所得溶液的溶质质量分数;
(3)实验室现有98%的浓硫酸20 g,需要多少克水才能配制成19.6%的稀硫酸?
小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员提示小明:氯化钙与碳酸钠反应的化学方程式:CaCl2+Na2CO3 =CaCO3↓+2NaCl。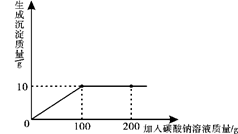
求:(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数。进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
| 物质 |
样品 |
消耗稀盐酸质量 |
反应后溶液质量 |
| 质量(g) |
9 |
75.4 |
80 |
试计算:(计算结果保留一位小数)
(1)样品中的NaHCO3质量分数;
(2)所得溶液中NaCl的质量分数。
下列五种溶液:①NaOH 溶液、 ②Ba(OH)2溶液、③Na2SO4溶液、④稀硝酸、⑤混有少量硝酸的MgSO4溶液
(1)指出其中属于碱溶液的(选填序号);
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克.需要20%的硫酸钠溶液多少克?
(3)若将Ba(0H)2溶液逐滴加人到混有少量硝酸的MgSO4溶液中,所得沉淀的质量与加入的
Ba(OH)2的质量变化符合下列图像的是(选填序号)·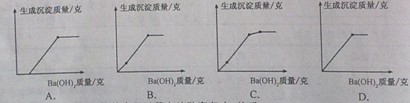
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。
第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称量,生成沉淀为5g。
(1)若该瓶试剂中的Na2CO3的质量分数为A,则氢氧化钠的质量分数 1-A(填大于、等于或小于),原因是 。
(2)计算该20g试剂中含有杂质Na2CO3的质量分数(结果精确到0.1%)。