实验室制乙酸乙酯1 mL后,沿器壁加入紫色石蕊试液0.5 mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡)。对可能出现的现象,叙述正确的是( )
| A.石蕊层仍为紫色,有机层无色 |
| B.石蕊层为三层环,由上而下是红、紫、蓝 |
| C.石蕊层有两层,上层为紫色,下层为蓝色 |
| D.石蕊层为三层环,由上而下是蓝、紫、红 |
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是()
| A.分离、提纯→确定化学式→确定实验式→确定结构式 |
| B.分离、提纯→确定结构式→确定实验式→确定化学式 |
| C.分离、提纯→确定实验式→确定化学式→确定结构式 |
| D.确定化学式→确定实验式→确定结构式→分离、提纯 |
构成下列结构片断蛋白质的氨基酸的种类和数目为()
| A.2种 | B.3种 | C.4种 | D.5种 |
菲的结构简式可表示为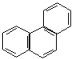 ,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有()
,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有()
| A.4种 | B.5种 | C.10种 | D.14种 |
分子式为C4H8O3的有机物,在一定条件下具有下列性质:①在浓硫酸作用下,能分别与CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,亦能脱水生成一种只存在一种结构形式,且能使溴水褪色的物质;③在浓硫酸存在下,还能生成一种分子式为C4H6O2的无支链环状化合物。根据上述性质,确定C4H8O3的结构简式为()
| A.HOCH2COOCH2CH3 | B.CH3CH(OH)CH2COOH |
| C.HOCH2CH2CH2COOH | D.CH3CH2CH(OH)COOH |
将有机物的混合液在一定条件反应:①甲醇与乙醇的混合物与浓硫酸加热得醚;②乙二醇与乙酸酯化得酯;③氨基乙酸和丙氨酸生成二肽;④乙烯和氯化氢反应,所生成的有机物的种类由多到少的顺序是()
| A.①②③④ | B.④③②① |
| C.③②④① | D.③①②④ |