在乙醛溶液中加入溴水,溴水褪色,分析乙醛的结构和性质,其反应原理有三种可能:①溴在不饱和键上发生加成反应;②溴与甲基上的氢原子进行取代;③乙醛具有还原性,被溴水氧化。为此同学们做了如下探究:
(1)向反应后的溶液中加入硝酸银溶液,有沉淀产生,则上述第________种可能被排除,有同学提出用测反应后溶液酸碱性的方法进一步进行验证,就可确定究竟是何种反应原理,请指出此方案是否可行________。理由是___________________________________。
(2)分析可能的反应,若乙醛被溴水氧化,氧化后的主要产物应是________。
(3)若反应物Br2与生成物Br-的物质的量关系是1∶2,则乙醛与溴水反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
已知某可逆反应:mA(g)+nB(g)  pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是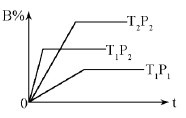
| A.T2>T1P1> P2 m+n > p Δ Η<0 |
| B.T1>T2P1< P2 m+n < p Δ Η>0 |
| C.T1<T2P1< P2 m+n < p Δ Η<0 |
| D.T1 >T2P1< P2 m+n > p Δ Η>0 |
室温下向10 mL c(H+)=10-3 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中 变大 变大 |
| C.醋酸的电离程度增大,c(OH-)亦增大 |
| D.再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应 |
水的电离过程为H2O H++OH-,在25℃、35℃时其离子积分别为
H++OH-,在25℃、35℃时其离子积分别为
K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列说法中正确的是
| A.水的电离过程是吸热过程 |
| B.c(H+)随着温度的降低而升高 |
| C.在35℃时,纯水中c(H+)>c(OH-) |
| D.水的电离度α(25℃)>α(35℃) |
对于化学反应方向的确定,下列说法正确的
| A.反应的焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,放热反应能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程与焓变无关 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH=?的化学反应,下列叙述不正确的是
| A.反应过程中能量关系如上图表示,则该反应为放热反应 |
| B.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C.化学反应的焓变与反应方程式的计量系数有关 |
| D.若将该反应设计成原电池,锌为负极 |