用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验
不合理的是 
| A.③中选用NaOH溶液吸收多余的SO2 |
| B.上下移动①中铜丝可控制SO2的量 |
| C.②中选用品红溶液验证SO2的生成 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
已知X、Y分别为同周期的ⅠA和VIA族的两种元素,它们的原子序数分别为a和b,则下列关系不可能成立的是()
| A.a=b –15 | B.a=b –29 | C.a=b – 9 | D.a=b –5 |
白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。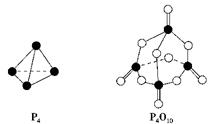
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
| A.(4c+12b-6a-5d)kJ·mol-1 |
| B.(6a+5d-4c-12b)kJ·mol-1 |
| C.(4c+12b-4a-5d)kJ·mol-1 |
| D.(4a+5d-4c-12b)kJ·mol-1 |
把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是( )
A.A>B>C>DB.A>C>D>BC.C>A>B>D D.B>D>C>A
在下图中的8个装置中,属于原电池的是( )
| A.①④⑤ | B.③⑥⑧ | C.④⑥⑦ | D.⑥⑦⑧ |
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是( )
| A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为: O2+2H2O+4e-===4OH- |
| B.以NaOH溶液为电解质溶液时,负极反应为:(提示:氢氧化铝溶于强碱)Al+3OH--3e-===Al(OH)3↓ |
| C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |