下列各种微粒的表示方法中,不正确的是
| A.碳-12的原子符号:126C | B.次氯酸分子的结构式:H—O—Cl |
| C.硫离子的电子排布式为:1s22s22p63s23p6 | D.二氧化硅的分子式:SiO2 |
下列说法正确的是()
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件下一定能够发生 |
| C.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热 |
| D.吸热反应必须在加热的条件下才能发生 |
有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
| A.HF | B.H3O+ | C.NaH | D.H2O2 |
某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是
A.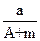 (A-N+m)mol (A-N+m)mol |
B.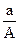 (A-N)mol (A-N)mol |
C.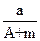 ( A-N)mol ( A-N)mol |
D.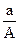 (A-N+m)mol (A-N+m)mol |
一定条件下,在体积为VL的密闭容器中,发生反应mA+nB=pC,t秒末,A减少了
1.0mol,B减少了1.25mol,C增加了0.5mol,则m: n:p为
| A.2:5:4 | B.4:5:2 | C.1:3:2 | D.1:4:5 |
下列各组物质中,含有相同的化学键的是
| A.HI和NaI | B.H2S和SO2 | C.Cl2和KCl | D.F2和NaBr |