火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热量,已知:0.8 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出513.3 kJ的热量。
(1)反应的热化学方程式为 ;
(2)又已知:H2O(g)===H2O(l);△H= —44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 ;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2分)在KCl、ZnCl2、ZnSO4三种盐配成的混合溶液中,已知K+为0.1mol、Zn2+为0.25mol,Cl-为0.2mol,则SO42-为mol.
(8分)有以下几种物质①熔融氯化钠②液态氯化氢③Cu④蔗糖⑤KAl(SO4)2⑥NaHCO3溶液,填空回答:(填序号)
(1)以上物质中属于电解质的是; 属于非电解质的是;能导电的是。
(2)写出⑤的电离方程式:。
下图装置B中是浓度均为0.1mol/L的NaCl、CuSO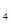 混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。
混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。
某学习小组用右图装置进行了有关电化学的实验。在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅拌棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。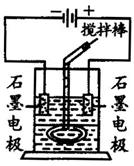
根据上述实验回答:
(1)阳极上的电极反应式为_______________________。
(2)环状玻璃搅拌棒的作用是______________________。
(3)原上层液体是___________。
(4)原下层液体是___________。
(5)搅拌后两层液体颜色发生变化的原因是:___________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是__________,现象是___________________。
(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
| 实验编号 |
0.01mol·L-1 酸性KMnO4溶液 |
0.1mol·L-1 H2C2O4溶液 |
水 |
1mol·L-1 MnSO4溶液 |
反应温度 /℃ |
反应时间 |
| I |
2mL |
2mL |
0 |
0 |
20 |
125 |
| II |
____mL |
____mL |
1mL |
0 |
20 |
320 |
| III |
____mL |
___mL |
___mL |
0 |
50 |
30 |
| IV |
2mL |
2mL |
0 |
2滴 |
20 |
10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至________时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 +H2C2O4 + H2SO4=K2SO4 + MnSO4 + CO2↑+ H2O