某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品。
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2。
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
| 溶 解 度 /g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
| Na2SO4 |
4.5 |
9.6 |
20.2 |
40.8 |
48.4 |
|
| CaCl2 |
59.5 |
65.0 |
74.5 |
100 |
116 |
|
| MgCl2 |
52.9 |
53.8 |
54.8 |
56.0 |
58.0 |
(1)10℃时,饱和Na2SO4溶液中溶质的质量分数是 (精确到0.1 %)。
(二)生产工艺
经上述处理后得到主产品:工业纯碱,副产品:A晶体。
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是 ;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱。在整个生产工艺中没有涉及到的基本反应类型是 ,可重复利用的是 (水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是 。
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
由上述实验可确定纯碱样品含有杂质 (写化学式)。
(四)含量测定
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解, 然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌。先发生反应:Na2CO3+HCl=NaHCO3+ NaCl;后发生反应:NaHCO3+HCl= NaCl+H2O+CO2↑。在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量 。
(7)请通过计算并结合左表判断此纯碱样品等级为 品。

为测定NaCl和Na2SO4固体混合物中NaCl的质量分数,化学小组同学进行如下实验活动:
由此测得原固体混合物中NaCl的质量分数是多少?(已知:Na2SO4+ BaCl2 ===BaSO4↓ + 2NaCl)
硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40 g倒入小烧杯中,向其中加入15%的硫酸铜溶液6.6 g,使过氧化氢完全分解。
计算:(1)过氧化氢溶液中溶质的质量为______g。
(2)产生氧气的质量(写出计算过程)。
(3)反应后所得硫酸铜溶液中溶质的质量分数(写出计算过程)。
纯碱样品中含有少量的氯化钠,某同学为测定纯碱样品中碳酸钠的含量,他取该纯碱样品12g,全部溶解在100g水中,再加入氯化钙溶液,所加氯化钙的质量如图所示。
请计算:
(1)纯碱样品中碳酸钠的质量。
(2)所加氯化钙溶液的溶质质量分数。
(计算结果保留到0.1%,下同)
(3)恰好完全反应后所得溶液中溶质的质量分数。
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图像分析回答下列问题:
原废液中的溶质成分有用化学式回答)。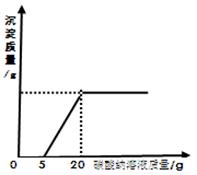
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如下实验数据:
| 实验次数 |
一 |
二 |
三 |
四 |
| 固体混合物的质量(g) |
20 |
20 |
20 |
20 |
| 加入NaOH溶液的质量(g) |
20 |
40 |
60 |
80 |
| 生成沉淀的质量(g) |
2.9 |
m |
8.7 |
8.7 |
问:(1)表中m的值为;
(2)原固体混合物中MgCl2的质量分数是多少?(要求写出计算过程)