
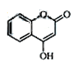
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: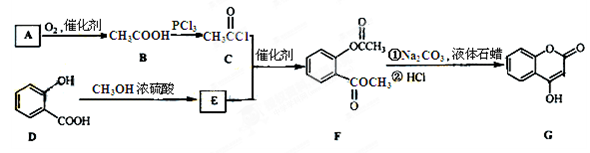
 ⑴A与银氨溶液反应有银镜生成,则A的结构简式是 ;
⑴A与银氨溶液反应有银镜生成,则A的结构简式是 ; ⑵B→C的反应类型是 ;
⑵B→C的反应类型是 ; ⑶E的结构简式是 ;
⑶E的结构简式是 ;  ⑷写出F和过量NaOH溶液共热时反应的化学方程式;
⑷写出F和过量NaOH溶液共热时反应的化学方程式;
 ⑸下列关于G的说法正确的是 。
⑸下列关于G的说法正确的是 。 a.能与溴单质反应 b. 能与金属钠反应
a.能与溴单质反应 b. 能与金属钠反应 c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
已知X为FeO和CuO的混合物,取两份等质量的X样品进行如图18-3所示实验: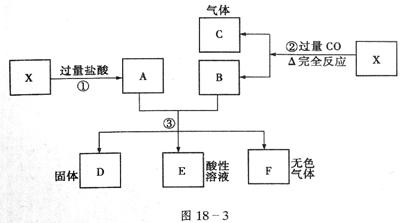
(1)写出第③步反应的离子方程式:__________________________
(2)实验中从第③步所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下的体积为5.6L。试计算取用的每份X中FeO和CuO的质量比。
反应3Fe(S)+4H 2O====Fe3O4(s)+4H2(g),在
2O====Fe3O4(s)+4H2(g),在 一可变的容积的密闭容器中进行,试回答:
一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是(填增大、不变、减 小,以下相同)
小,以下相同)
②将容器的体积缩小一半,其正反应速率,逆反应速率 。
。
③保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
④保持压强不变,充入N2使容器的体积增大,其正反应速率,逆反应速率。
有两个起始体积相同的密闭容器A和B, A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
为2 ∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴ 达到平衡所需时间,A容器比B容器_______,两容器中SO2的转化率A比B______。
⑵ 达 到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动
到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动 。
。
⑶ 达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________,B容器中SO3的体积分数__________(填变大、变小、不变)。
22.反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题:
C(g) +D(g)过程中的能量变化如图所示,回答下列问题: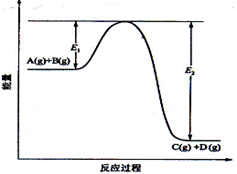
(1)该反应的反应物总能量________生成物的总能量(选填“ 小于”“大于”或“相等”)。
小于”“大于”或“相等”)。
(2)当反应达到平衡时,若升高温度,A的转化率_____(选填“增大”“减小”“不变”原因是____________
____________;若增大压强,则V正 V逆(选填“<”“>”“=”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1____,E2_____(填“增大”“减小”“不变”)。
红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程:
;温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3=;
P和Cl 2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。
2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。