已知X为FeO和CuO的混合物,取两份等质量的X样品进行如图18-3所示实验: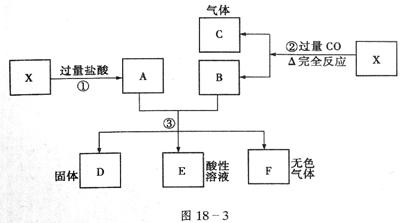
(1)写出第③步反应的离子方程式:__________________________
(2)实验中从第③步所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下的体积为5.6L。试计算取用的每份X中FeO和CuO的质量比。
一瓶澄清透明的溶液,可能含有下列离子中的一种或几种:Fe2+、Fe3+、Ba2+、Al3+、NH4+、SO42-、 HCO3-、NO3-、Cl-取溶液进行如下实验:
①溶液滴在蓝色石蕊试纸上,试纸呈红色。
②取少量溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成。
③取少量溶液,加入用硝酸酸化的氯化钡溶液,产生白色沉淀。
④另将③中的沉淀过滤出,滤液中加入硝酸银溶液,生成白色沉淀
⑤另取原溶液,逐滴加入氢氧化钠溶液至过量,先看到生成沉淀,随之该沉淀部分溶 解,并呈红褐色。
根据上述实验现象推断:
(1)溶液中肯定存在的离子有。
(2)溶液中肯定不存在的离子有。
(3)溶液中不能确定是否存在的离子有。
(4)对上述实验操作做何改进,才能确定(3)中的离子是否存在
在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。
(1)若铜片还有剩余,硫酸__ __消耗完毕(填“已”或“没有”)。其理由是
。
(2)用一定量的废铜屑制取胆矾,有两种方法:第一种是取Cu与浓H2SO4直接反应;第二种是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中__种方法好,理由是____ ____。
将a mol的Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。
(1)当剩余固体为Na2CO3,排出气体为O2,H2O时,a:b的值为________。
(2)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,a:b的值为________。
(3)当a:b>1时,剩余固体为________,排出气体为________。
(4)当排出的O2和H2O为等物质的量时,则a:b的值为________。
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转换关系如下图所示(部分产物略去)。
(1)若A为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于分子(填“极性”或“非极性”),B分子中所有原子是否都满足8电子结构,(填“是”或“否”)。
②向50 mL 4 mol/L的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中的溶质为_______(填化学式),物质的量分别为_____________。
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式。
②写出A和B在溶液中反应的离子方程式。
(3)若A为常见的金属,在E的冷、浓溶液中有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的固体X,该反应的离子方程式为。