已知:A、B、C、D分别为中学化学中常见的4种不同微粒,它们之间有如图1-3所示的反应关系: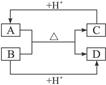
图1-3
(1)如果A、B、C、D均是10电子微粒,请写出:
A的化学式:_____________;C的电子式:_____________。
(2)如果A和C是18电子的微粒,B和D是10电子微粒,请写出:
A与B在溶液中反应的离子方程式:__________________________________________
苹果酸(HOOC—CHOH—CH2COOH)常用于汽水、糖果的添加剂,
写出苹果酸分别与下列物质反应的化学方程式
①Na
②CH3CH2OH(H2SO4,△)
现有5种有机物:①乙烯,②乙醇,③乙醛,④乙酸,⑤乙酸乙酯。
(1)请分别写出其中含有下列官能团的有机物的结构简式
①-OH________ ②-CHO________ ③-COOH________
(2)在上述5种有机物中(填写序号)
①能发生银镜反应的是。
②能发生水解反应的是
③具有酸性且能发生酯化反应的是
④既能发生加成反应,又能发生聚合反应的是
(14分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗盐酸溶液体积/mL |
19.00 |
23.00 |
23.04 |
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有_____
A. 配制标准溶液定容时,加水超过刻度 B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。
(11分)工业上制备BaCl2的工艺流程图如图7:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)△H1 =" +571.2" kJ·mol-1①
4CO(g) + BaS(s)△H1 =" +571.2" kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s)△H2=" +226.2" kJ·mol-1②
2CO2(g) + BaS(s)△H2=" +226.2" kJ·mol-1②
(1)高温焙烧时常把原料粉碎,目的是_________________________________
(2)常温下,相同浓度的Na2S和NaHS溶液中,说法正确的是:(3分)
| A.Na2S溶液的pH比NaHS溶液pH大 |
| B.两溶液中含有的离子种类不同 |
| C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等 |
| D.两溶液中加入NaOH固体,c(S2-)都增大 |
E. NaHS溶液中:c(Na+) > c(HS-)> c(OH-) > c(H+) > c(S2-)
(3)反应C(s) + CO2(g) 2CO(g)的△H =
2CO(g)的△H =
(4)制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:
(5)实际生产中必须加入过量的炭,同时还要通入空气,目的是:
(写出一种原因即可)
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行()次实验。
| A.1 | B.2 | C.3 | D.4 |
(4)实验室配制和保存FeCl3溶液,要向其中加入________,防止其水解变质。
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.